完全缓解率60%!罗氏CD20xCD3双抗获批上市
12月22日,罗氏旗下基因泰克宣布,FDA已批准CD20xCD3 双特异性抗体 Lunsumio的上市申请,用于治疗至少两线系统治疗后复发或难治性(R / R)滤泡性淋巴瘤(FL)患者。Lunsumio成为了FDA批准治疗非霍奇金淋巴瘤的首个 CD20xCD3 T细胞接合双抗,它代表着一种无化疗、现货型(off-the-shelf)新肿瘤免疫治疗选择,患者无需等待即可门诊环境下接受静脉输注治疗。

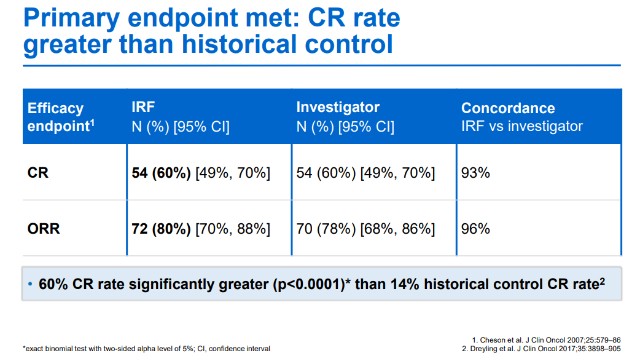
Lunsumio是一种first-in-class的CD20xCD3 T细胞接合双特异性抗体,旨在靶向B细胞表面的CD20和T细胞表面的CD3,通过双重靶向激活并重定向患者现有的内源性T细胞,并将细胞毒性蛋白释放到B细胞中来消除恶性B细胞。 今年6月,欧盟委员会基于GO29781研究率先授予Lunsumio有条件上市许可。此次FDA的获批也是基于II期开放标签GO29781研究的积极结果。 GO29781研究展现出Lunsumio长久的临床疗效和较高的完全缓解 (CR) 率。中位随访18.3个月后,客观缓解率(ORR)为 80%(n=72),也就是说在既往接受至少两种治疗的患者中有80%实现了持久的缓解,其中60%的患者达成完全缓解。中位缓解持续时间为 22.8 个月。
在218例以推荐剂量接受Lunsumio治疗的血液系统恶性肿瘤患者中,最常见的不良事件是细胞因子释放综合征(CRS,39%),这些事件有可能比较严重并危及生命,CRS事件的中位持续时间为3天(范围:1-29)。其他常见的不良事件(≥20%)包括疲劳、皮疹、发热和头痛。
此前,FDA已经授予Lunsumio突破性治疗认定(BTD)和孤儿药资格,用于治疗至少接受过两种先前系统治疗的R/R FL的成人患者。
目前,Lunsumio仍在开展多项临床研究,包括联合来那度胺二线治疗FL的CELESTIMO研究,以及联合维博妥珠单抗二线治疗弥漫性大B细胞淋巴瘤的SUNMO研究等两项III期研究。此外,罗氏也正在致力于Lunsumio皮下制剂的开发。
“尽管治疗取得了进展,但滤泡性淋巴瘤仍然无法治愈,复发很常见而且每次连续治疗后结果都会恶化。”首席医疗官兼全球产品开发负责人Levi Garraway博士表示:“Lunsumio是我们首个获批的T细胞接合双抗,建立在我们血液肿瘤领域20多年的创新传统之上。”
Copyright 2022 PHARMCUBE. All Rights Reserved.
欢迎转发分享及合理引用,引用时请在显要位置标明文章来源;如需转载,请给微信公众号后台留言或发送消息,
免责申明:本微信文章中的信息仅供一般参考之用,不可直接作为决策内容,医药魔方不对任何主体因使用本文内容而导致的任何损失承担责任。
郑重声明:用户在社区发表的所有信息将由本网站记录保存,仅代表作者个人观点,与本网站立场无关,不对您构成任何投资建议,据此操作风险自担。请勿相信代客理财、免费荐股和炒股培训等宣传内容,远离非法证券活动。请勿添加发言用户的手机号码、公众号、微博、微信及QQ等信息,谨防上当受骗!

郑重声明:东方财富网发布此信息的目的在于传播更多信息,与本站立场无关。东方财富网不保证该信息(包括但不限于文字、视频、音频、数据及图表)全部或者部分内容的准确性、真实性、完整性、有效性、及时性、原创性等。相关信息并未经过本网站证实,不对您构成任何投资建议,据此操作,风险自担。

