近日,信立泰收到子公司美国 Salubris Biotherapeutics的通知,其在美国心衰协会(HFSA)2023年度科学会议最新发布口头汇报专场公布了 JK07治疗HFrEF(射血分数降低的心衰)的美国Ib期临床试验的积极数据。

JK07的Ib期临床试验为随机、双盲、安慰剂对照、剂量递增研究,目前试 验已完成并获得完整分析数据。
数据显示,JK07显示出良好的安全性、初步疗效,并确定了治疗安全窗。在耐受剂量范围内,JK07在HFrEF的生物标志物改善、疗效指标上都有优秀的表现。JK07单次给药6个月内可使左室射血分数呈现具有临床意义的改善,这种持续的反应表明JK07具有改善患者心功能、生活质量和长期疗效的潜力。公司将在II期多次给药临床试验中进一步评估JK07在HFrEF和HFpEF(射血分数保留的心衰)患者中的疗效和安全性。
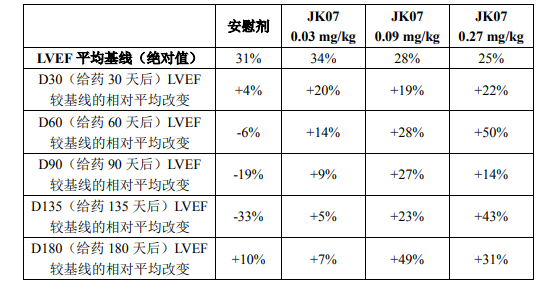
与安慰剂组相比,JK07在所有剂量组均显示出有临床意义的 LVEF(左室射 血分数)的改善,且靶点相关的替代生物标志物呈剂量依赖性改变。D180(单次给药180天后),中、高剂量组LVEF平均改善≥31%。JK07总体耐受性良好, 大多数不良事件为轻度至中度,仅在最高剂量组发生一例严重不良事件(3 级)。
JK07 已完成的Ib期临床研究包括三个剂量组,14名NYHA II/III级心衰患 者按 3:1 随机接受JK07或安慰剂治疗(11例JK07:3例安慰剂)。其中前二组(剂量分别为 0.03mg/kg、0.09mg/kg)各有5名患者入组,第三组(0.27mg/kg) 有4名患者入组。给药方式为单次静脉给药,评估患者 LVEF较基线的变化。
与安慰剂组相比,JK07所有剂量组的LVEF变化如下:
JK07(中国项目代码:SAL007,重组人神经调节蛋白 1(NRG-1)-抗 HER3抗体融合蛋白注射液)是公司自主研发、具有全球知识产权的NRG1融合抗体药物,是心衰领域首个进入临床开发阶段的选择性ErbB4 激动剂,拟开发适应症包括 HFrEF(射血分数降低的心衰)和 HFpEF(射血分数保留的心衰)。
该产品是公司第一个中美双报的创新生物药,美国、中国同时开展了I期临床试验(HFrEF 适应症),中国的I期临床已完成两个剂量组的入组和揭盲,正 进行患者随访及数据清理等工作。美国 Salubris Bio 计划近期向FDA提交慢性心衰(HFrEF及HFpEF适应症)的II期临床试验申请,预计将于 2024年上半年正式启动II期临床患者入组工作。
关注wechat药研网
本文作者可以追加内容哦 !

