
药融云美国FDA批准药品数据库显示,12月7日,美国FDA已批准诺华公司(Novartis)的Fabhalta(iptacopan)上市,这是首款针对成人阵发性睡眠性血红蛋白尿症(paroxysmal nocturnal hemoglobinuria, PNH)的口服单药疗法。Fabhalta是一种补体B因子抑制剂,它在免疫系统的替代补体途径中起作用,全面控制血管内外的红细胞(RBC)破坏。
首款PNH口服单药疗法获批,成为潜在重磅疗法之一
在临床试验中,Fabhalta表现出显著的治疗效果。在3期临床试验APPLY-PNH中,几乎所有使用Fabhalta的患者都没有接受输血。这款药物被行业媒体Evaluate列为10款值得关注的潜在重磅疗法之一。
FDA的批准是基于两项关键的3期临床试验——APPLY-PNH和APPOINT-PNH。APPLY-PNH试验主要针对接受过抗C5疗法治疗的患者,而APPOINT-PNH试验则针对未接受过补体抑制剂治疗的患者。两项试验的结果均显示,Fabhalta在提高血红蛋白水平和避免输血方面显著优于继续使用抗C5疗法治疗的患者。
APPLY-PNH临床试验信息查询
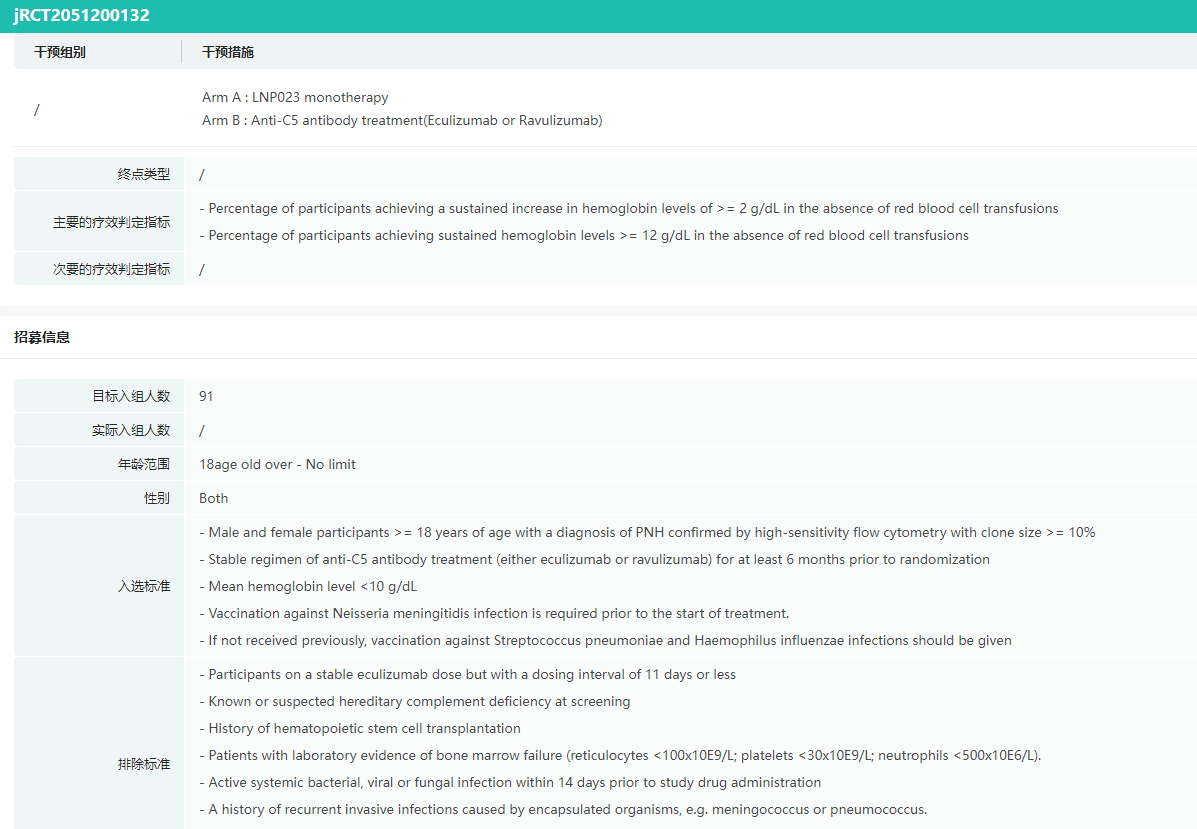
APPLY-PNH和APPOINT-PNH试验24周的主要发现显示,82.3%接受过抗C5疗法治疗的患者在无输血的情况下,接受Fabhalta治疗后血红蛋白水平持续增加≥2 g/dL,继续接受抗C5疗法治疗的患者这一数值为0%(P<0.0001)。未接受过补体抑制剂治疗的患者中,77.5%的患者接受Fabhalta治疗后达到了这一结果。
此外,在无输血的情况下,67.7%接受过抗C5疗法治疗的患者血红蛋白水平持续≥12 g/dL,继续接受抗C5疗法治疗的患者这一数值为0%(P<0.0001)。对于接受过抗C5疗法治疗的患者,接受Fabhalta治疗后避免输血率为95.2%,而抗C5疗法组患者这一数值为45.7%(P<0.0001)。
在安全性方面,在APPLY-PNH试验中,Fabhalta与抗C5疗法相比最常报告的不良反应(≥10%)包括:头痛(19%比3%),鼻咽炎(16%比17%),腹泻(15%比6%),腹痛(15%比3%),细菌感染(11%比11%),恶心(10%比3%)和病毒感染(10%比31%)。在APPOINT-PNH试验中,最常报告的不良反应(≥10%)包括头痛(28%),病毒感染(18%),鼻咽炎(15%)和皮疹(10%)。
在APPLY-PNH中,接受Fabhalta治疗的PNH患者中有两名(3%)报告了严重的不良反应,包括肾盂肾炎、尿路感染和COVID-19。在APPOINT-PNH中,接受Fabhalta治疗的PNH患者中有两名(5%)报告了严重的不良反应,包括COVID-19和细菌性肺炎。
Fabhalta是诺华公司的重点研发项目之一,这项突破性的批准为PNH患者提供了一种新的治疗选择,有望改变临床实践。除了用于治疗PNH,它在治疗IgA肾病的3期临床试验中也已达到主要终点,预计于2024年递交加速批准的监管申请。
“三足鼎立”格局被打破,国内外竞相布局PNH治疗药物
阵发性睡眠性血红蛋白尿症(paroxysmal nocturnal hemoglobinuria, PNH)是一种获得性克隆性造血干细胞疾病,全球发病率约为1~2/百万, 亚洲地区的发病率相较西方更高。PNH患者的临床表现主要为不同程度的发作性血管内溶血、阵发性血红蛋白尿、骨髓造血功能衰竭和静脉血栓形成等。
PNH的治疗以支持治疗为主,针对补体远端通路的抗补体(anti-C5)治疗是目前公认的PNH标准治疗方案。药融云数据库显示,截至目前,全球获批了6款治疗PNH的药物,包括阿斯利康旗的Soliris(依库珠单抗)和Ultomiris(ravulizumab)、Apellis Pharmaceuticals/苏庇医药的Empaveli(pegcetacoplan)以及三款依库珠单抗类似药(三星生物的AM-004、安进的ABP-959、International Biotechnology Center Generium LLC的eculizumab biosimilar)。
全球获批上市的PNH治疗药物

目前,PNH市场主要由阿斯利康旗下的两款C5药物Soliris(依库珠单抗)和Ultomiris(ravulizumab)占据。2007年3月,由Alexion研发的首款C5补体抑制剂Soliris获批上市,每周或每2周给药一次。2018年底,其另一款C5补体抑制剂Ultomiris上市,Ultomiris是Soliris的长效版,需每4周或每8周给药一次。2020年12月,阿斯利康斥资390亿美元收购了Alexion,由此树立起在PNH领域的主导地位。
阿斯利康年报数据显示,2020年Soliris销售额突破40亿美元,Ultomiris销售额突破10亿美元。2022年前9个月,Soliris为阿斯利康带来29.2亿美元的收入,而Ultomiris的销售额为13.7亿美元。
在Soliris和Ultomiris占据市场长达十几年后,靶向另一个补体靶点的Empaveli(pegcetacoplan)横空出世。2021年5月,Empaveli经FDA批准上市,成为近15年来首个新补体药物类型,也是首个FDA批准用于治疗PNH的C3靶向疗法。
Empaveli(pegcetacoplan)由Apellis Pharmaceuticals研发,可与补体蛋白C3及其激活片段C3b结合,从而调节C3的裂解和补体激活的下游效应子的产生。Empaveli在补体级联的近端起作用,控制C3b介导的血管外溶血和末端补体介导的血管内溶血。
如今,诺华的Iptacopan获批上市,又将对该领域造成新的冲击。Iptacopan是通过口服使用,相对于注射药物来说更为方便。
国内PNH治疗药物TOP10研发企业
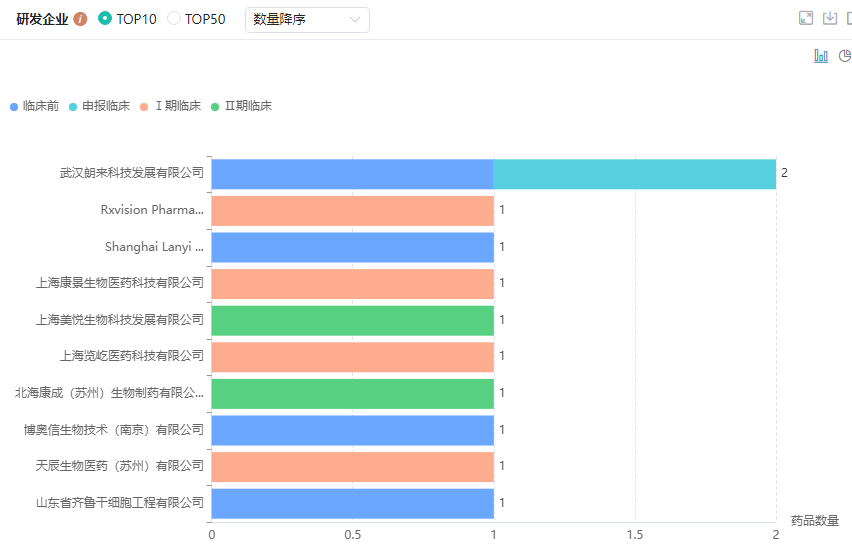
目前,国内获批上市的PNH治疗药物仅阿斯利康的依库珠单抗,还有3款处于申请上市阶段,阿斯利康的ravulizumab、$罗氏(ADR)(OTCBB|RHHBY)$的crovalimab、$诺华制药(NYSE|NVS)$的iptacopan。除此之外,国内PNH市场中还有许多其他补体药物也正蓄势待发,比如$再生元制药(NASDAQ|REGN)$的pozelimab,恒瑞医药子公司盛迪医药的HRS-5965,北海康城的CAN106注射液,科越医药的KP-104、美悦生物的MY-008211A等也都正在进行临床试验中。
<END>
本文作者可以追加内容哦 !

