2月16日,Iovance Biotherapeutics表示,FDA已批准AMTAGVI™(lifileucel),用于晚期黑色素瘤成年患者的细胞疗法,这是全球首款获批上市用于实体瘤癌症的一次性个体化TIL细胞疗法。


黑色素瘤是一种皮肤癌,通常是由暴露于紫外线引起的,紫外线可能来自阳光或室内晒黑。尽管黑色素瘤仅占所有皮肤癌的约 1%,但它们占癌症相关死亡人数的很大一部分。如果不及早发现和治疗,黑色素瘤会扩散到身体的其他部位,导致转移性疾病。
不可切除或转移性黑色素瘤的治疗可能包括使用 PD-1 抑制剂进行免疫治疗,PD-1 抑制剂是靶向体内某些蛋白质的抗体,可帮助免疫系统抵抗癌细胞。此外,靶向 BRAF 基因的药物有助于管理细胞的生长和功能,可用于治疗与 BRAF 基因突变相关的黑色素瘤。那些黑色素瘤通过这些疗法进展的患者有很高的未满足的医疗需求。
Lifileucel(品牌名Amtagvi),是一种肿瘤衍生的自体 T 细胞免疫疗法,由患者自身的抗病白细胞(称为 T 细胞)组成,具有称为肿瘤浸润淋巴细胞 (TIL) 的特定类型。适用于治疗既往接受过 PD-1 阻断抗体治疗的不可切除或转移性黑色素瘤成年患者,如果 BRAF V600 突变阳性,则用于治疗 BRAF 抑制剂联合或不联合 MEK 抑制剂。该适应症根据总体缓解率 (ORR) 和缓解持续时间获得批准。

Amtagvi的加速批准是基于一项开放标签、多队列、多中心的II期试验C-144-01, 目的为检视单次注射lifileucel在晚期黑色素瘤患者身上的安全性和有效性。所有患者在接受免疫检查点抑制剂治疗和 BRAF/MEKinhibitor 靶向治疗后均取得了进展。
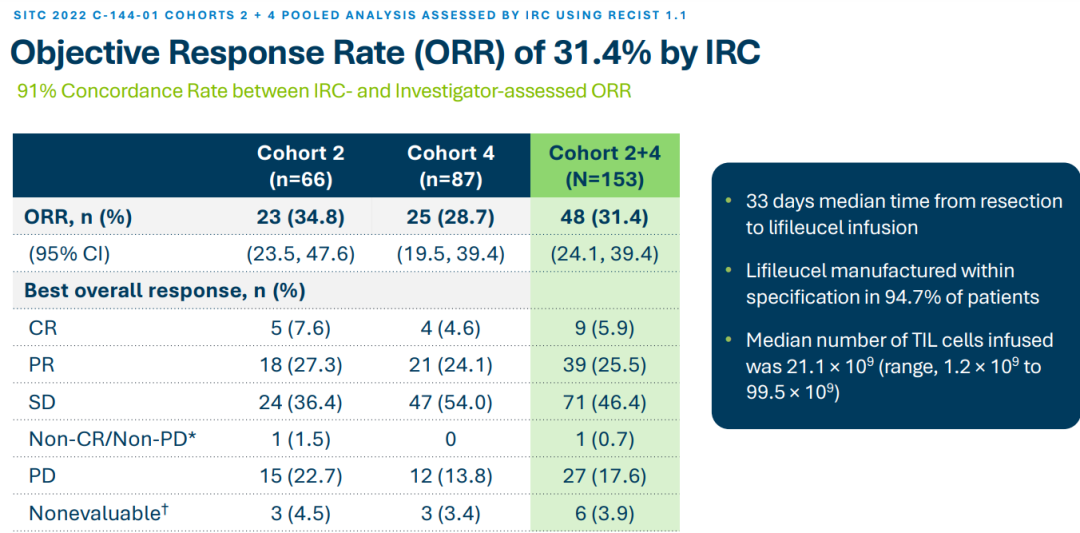
该研究共分为4个队列,其中队列1(n=30)患者接受非冷冻保存的TIL产品治疗;队列2(n=66)和队列4(n=75)患者皆接受经冷冻保存的TIL治疗;队列3(n=~10)为重复接受TIL治疗患者。

在推荐剂量的队列4的73例Amtagvi治疗患者中,客观缓解率为31.5%,其中3例(4.1%)患者完全缓解,20例(27.4%)患者部分缓解。在对治疗有反应的患者中,分别有56.5%、47.8%和43.5%的患者在6个月、9个月和12个月时继续维持反应,没有肿瘤进展或死亡。

综合来看队列4和队列2,Amtagvi在150名患者中约三分之一的患者中缩小了肿瘤,客观缓解率为31.4%。其中一半的答复至少持续了一年,而答复的调解期限在21.5个月后仍未达到。
Iovance还在进行一项3期试验TILVANCE-301,该研究将单独测试Amtagvi或与默克的检查点抑制剂Keytruda一起作为黑色素瘤的一线疗法,目的确认该疗法的临床益处。预计将在2028年至2030年之间结束。Iovance还在宫颈癌中测试Amtagvi,并在头颈癌和肺癌中测试类似的TIL疗法。该公司还拥有早期阶段的项目,以增强TILs,并希望通过基因编辑提高对治疗的反应率。

此次Amtagvi 被批准作为二线或三线治疗选择,用于接受常用检查点抑制剂免疫疗法治疗后仍患有黑色素瘤的患者。患者还必须在接受Amtagvi之前进行化疗,以便为传入的细胞腾出空间。
该疗法带有一个黑匣子警告,警告低血细胞计数、感染、心脏病、肺或肾功能障碍或致命并发症的风险。副作用还包括发冷、疲劳、发烧、肿胀和心率异常加快。

据报道,全球每年约有32.5万新发黑色素瘤患者,其中每年约有5.7万患者因该病死亡;美国每年约有10万人被诊断出患有黑色素瘤,约有7700人死于该疾病。
细胞疗法制造中心的联合创始人兼首席执行官Jason Bock博士说,“TIL疗法的潜在市场相当大,因为90%的癌症是实体瘤,而血癌只有10%。”
TIL疗法是由美国国家癌症研究所科学家Steve Rosenberg于20世纪80年代首创的,该疗法基于这样一种观察:免疫细胞可以穿透并攻击肿瘤,但由于癌症的无情防御,免疫细胞在完成任务之前往往会被卡住或失去动力。Iovance 公司将这些细胞从病人的肿瘤中分离出来,在实验室中进行培养,然后将恢复活力的细胞重新注入病人体内,希望它们能攻击肿瘤。
TIL疗法为实体瘤患者提供了一个有前途的选择。FDA也为第一种针对实体瘤的细胞疗法开了绿灯。Amtagvi此前还获得了孤儿药、再生医学先进疗法、快速通道和优先审评资格。
关注wechat药研网
本文作者可以追加内容哦 !

