一次治疗51.5万美元,比CAR-T还贵的肿瘤浸润淋巴细胞(TIL)疗法,在FDA获批不到2周,吸引了20名患者。TIL疗法有何魔力?
撰文| Kathy
编辑| 顿河
新英格兰杂志(NEJM)曾在2016年发表过这样一个案例。
49岁的Celine Ryan被确诊为III期结肠癌,在经历了标准治疗后,癌症仍然不断复发,并且由结肠转移至了肺部,并长出7个肿瘤。走投无路的情况下,Celine参加了美国国立癌症研究所(NCL)开展的一项关于免疫细胞治疗的临床试验。
奇迹发生了。在接受回输免疫细胞后,Celine的肿瘤病灶开始逐渐缩小,十个多月后,肺部的7个转移病灶全部消失了。让她重获新生的免疫细胞疗法,正是TIL疗法。而负责这项临床试验的则是被称为免疫学泰斗的全球知名的肿瘤学家Steven Rosenberg。
事实上,距离Rosenberg发现并将TIL疗法首次应用于人体的肿瘤治疗已经过去了近40年,2024年初,全球首款TIL细胞疗法终于获批上市了。
2月16日,TIL疗法龙头公司Iovance宣布旗下产品Amtagvi(Lifileucel)获FDA加速批准上市,Iovance的股价也在短短几个交易日上涨超75%。
51.5万美元,约合370万元的TIL疗法,定价比目前全球所有获批上市的CAR-T都更贵,Iovance能打开TIL疗法的市场吗?商业化前景成了突破上市瓶颈后下一个被关注的问题。2月29日,Iovance高调宣布:在获批12天的时间里,Amtagvi已经吸引了20名患者。TIL疗法究竟有何魔力?
CGT鼻祖打响实体瘤第一“枪”
TIL疗法算得上是细胞疗法的“鼻祖”。
早在1988年,Steven Rosenberg通过对TIL细胞的研究和改进,发现TIL是一种对实体肿瘤有着天然归巢优势的细胞免疫疗法,通过“从患者的肿瘤中分离出淋巴细胞,将分离的细胞在体外激活扩增或加以改造,然后再回输到患者体内”的方法,能够用于人体肿瘤治疗。
然而,从Steven Rosenberg的探索发现,到如今全球首个TIL疗法产品上市,走了将近40年。
2011年,肿瘤免疫疗法公司Genesis Biopharma与NCI签订合作研发协议,从Rosenberg的团队引进了TIL技术,开发过继性细胞免疫疗法。
2013年Genesis与下一代肿瘤学公司Lion Biotechnologies合并,合并后的新公司在2017年更名为Iovance Biotherapeutics,也就是如今全球首款TIL疗法Amtagvi的拥有者。
当前肿瘤免疫细胞治疗主要有CAR-T、TCR-T、TIL和CAR-NK 等。在这之中,CAR-T技术可以说是技术最成熟、赛道最火热的。目前全球已获批上市多款CAR-T药物,不过,适应证均集中于血液肿瘤领域。虽然CAR-T疗法对血液肿瘤的有效率可达70%以上,但血液肿瘤仅占全球新发肿瘤的10%,何时能将适应证突破至实体瘤是CAR-T药物开发者们不懈的追求。
而TIL疗法虽然在上市的脚步落后CAR-T一大截,但随着Amtagvi此次获批了黑色素瘤的相关适应证,可以说是实实在在地“吹响”了细胞疗法攻克实体瘤的号角。有行业分析认为,TIL疗法解决了CAR-T乃至其他细胞疗法难以彻底解决的实体瘤难题,以“没有特定靶点”的手段回应了“缺乏靶点”的问题,以“来自肿瘤微环境”克服“肿瘤微环境限制”。
Amtagvi的获批是基于治疗晚期黑色素瘤患者的II期临床试验C-144-01的阳性结果,试验对象是在之前的抗PD-1/L1治疗和靶向治疗期间或之后发生进展的晚期黑色素瘤患者。
Amtagvi在目前推荐的剂量范围内使73名先前接受过PD-1治疗的患者中有31.5%的肿瘤缩小。经过18.6个月的随访,43.5%的应答者病情缓解超过一年。在一项包括153名患者的支持性汇总疗效分析中,客观缓解率相似,为31.4%。此外,56.3%的应答者在一年内保持了持久的缓解,效果明显。
在TIL疗法的布局上,Iovance可谓野心勃勃。
Amtagvi目前已经布局了开发包括肺癌、宫颈癌等多个癌种的多个分型与多线治疗方案的临床试验。作为在TIL疗法绝对的龙头,除了刚刚上市的Amtagvi,Iovance目前在研的LN-145已经已进入Pivotal试验,已被FDA授予突破性疗法认定,用于治疗在接受化疗后复发、转移性或持久性宫颈癌患者。进展较快的LN-145-S1(PD-1选择性TIL疗法)和LN-145-Gen3(第三代TIL疗法)则均已进入临床II期。
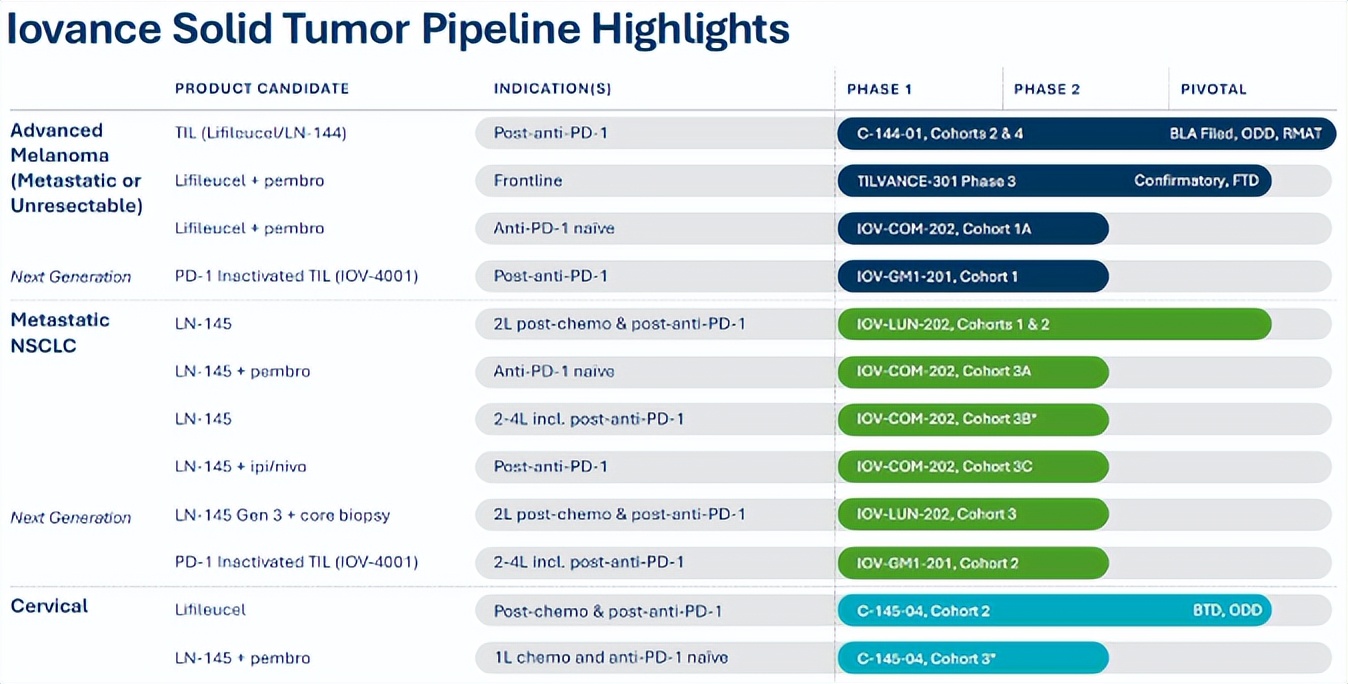
来源:Iovance官网
有分析师认为Amtagvi将改变在黑色素瘤的治疗格局,但预测的销售峰值15亿美元显然没有达到Iovance的心理预期。从Iovance的研发管线布局不难看出,为了扩大Amtagvi的市场覆盖范围,Lovance 一直在测试该产品与抗癌疗法的联合使用,并一直在探索其在其他类型癌症中的使用。
商业化准备好了?
过去几年,“全球首个TIL疗法即将面世”的预测几乎会出现在每一年的“当年最具突破性新药”名单中。然而Amtagvi的上市却总差了临门一脚。
Iovance原计划于2020年底提交BLA申请。但在2020年10月5日召开的会议上,Iovance未能就全面定义Amtagvi所需的效力分析与FDA达成一致,受此影响,Amtagvi的上市申请计划从2020年底推迟到2021年。
到了2021年5月,FDA表示希望获得更多关于Amtagvi效力分析的数据,Amtagvi的上市申请计划被推迟至2022年。
2022年8月,Iovance宣布已经向FDA启动关于TIL疗法Amtagvi的滚动上市申请。至次年3月,申请完成滚动提交。Amtagvi是首个向FDA提交BLA的TIL法。
2023年9月,FDA因“资源有限”无法完成在原定的2023年11月25日前完成审评,并将目标日期推迟到2024年2月24日。
虽然几经波折,但好在TIL疗法最终还是成功上市。Iovance表示,在美国首次上市后,将继续推进Amtagvi在全球其他国家,包括欧盟、英国、加拿大、澳大利亚等地区上市,以覆盖更多Amtagvi可治疗的患者,并预计患者总数增加一倍以上。
从实验室成功完成产业转化,产业将目光瞄准了Iovance的生产与商业化。
TIL的技术原理决定了TIL的生产体系甚至要比CAR-T还复杂。采用TIL疗法的前提需要患者首先进行肿瘤切除手术。换言之,通过TIL疗法治疗需要是可以切除的肿瘤,并且在切除样本中获得足量的TIL。在通过手术获得具有足量TIL的活性样本后,需要经历大约34天的制备流程。患者还需要通过淋巴细胞清除预处理,再重新输注TIL。同时患者还需要持续注射大剂量的IL-2以继续保持细胞活性,但大剂量的IL-2本身就具有生物毒性。
生产成本高、体内持久性弱、对IL-2依赖度高、肿瘤微环境免疫抑制等等都成了TIL疗法的痛点与亟待解决的难题。
Amtagvi从获得肿瘤到完成生产和质控的时间是34天,Iovance新一代生产工艺需要22天生产时间。复杂的制备让TIL比CAR-T更昂贵。Iovance目前披露的TIL疗法定价为51.5万美元,并且不包含IL-2的费用,而IL-2是必须与TIL疗法同时使用的重要一环,一次剂量的IL-2费用是5855美元。
为保证IL-2的持续稳定供应,早在2023年1月时,Iovance就以1.67亿英镑的预付款,收购了诺华的IL-2产品Proleukin的全球权益。彼时有分析师指出,Iovance既能够获得IL-2产品的稳定收益,还能将IL-2的供应与物流、使用以及后续临床试验的成本降至最低。
Iovance在财报中表示,FDA获批后一周内就开始在其细胞疗法中心内部生产Amtagvi。从Iovance 2月20日的公告来看,药明康德子公司药明生物将作为CDMO生产Amtagvi,并获得了在其费城工厂生产该疗法的美国授权。“内部和外部生产能力应能每年为数千名患者提供治疗。”
同时,Iovance表示,FDA批准的生产能力高于目前Iovance的水平。为满足可及性,公司正在扩大医疗中心。Iovance首席执行官Frederick Vogt表示,Iovance计划至今年5月底在美国上线50个授权治疗中心,目前已有30个完成了招募。并且,目前已有至少20名患者正在接受治疗,其中包括已经安排或等待制造时间的十名患者。
在产品获批后的电话交流会上,Iovance虽然没有披露详细的支付规则,但该公司表示治疗费用75%以上的费用将由商保、Medicare Part C等支付方承担,总体类似于CAR-T产品。
TIL疗法通常需要患者到指定的专门的医疗机构,即ATC(Authorized Treatment Centers专业授权治疗中心)。目前Iovance已在全美布局了30家ATC,并计划未来3个月内再布局20家。
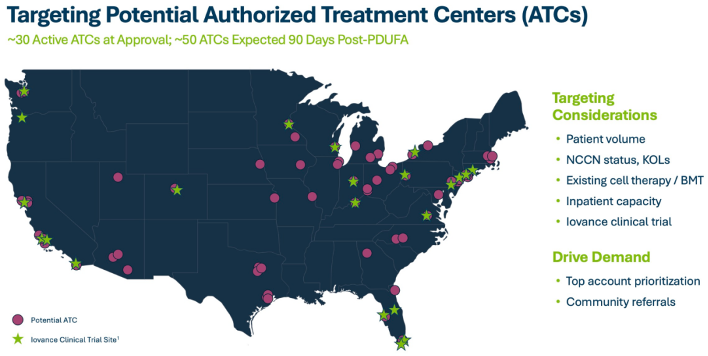
来源:Iovance官网
据Iovance官网,该公司已经与ATC合作建立了TIL服务线,并为Amtagvi开发了一款APP——IOVANCE CARES,为符合条件的患者提供共付额支持、经济援助以及旅行和住宿援助等服务。
可以说,Iovance已经在生产、商业化、准入与支付端摩拳擦掌,做好了充足的准备。
本文作者可以追加内容哦 !

