自2015年国务院“44号文”掀起药审改革浪潮,鼓励药品创新研发已经成为医药行业主旋律,审评审批加速帮助药企在前端降低成本,知识产权保护为新药研发构筑围墙,拉长药企获益周期,增强研发信心。
新药研发是一个风险高、投资大、周期长的过程,药物有效性与安全性数据的获得需要进行长期推进和不断拓展的临床试验,并为此持续投入大量的人力与物力。因此,知识产权保护需要贯穿药品的全生命周期,既包括专利保护,也包括药品试验数据保护制度。
在2023年新修订的《中华人民共和国专利法实施细则》中,专利保护已经得以落实,药品知识产权保护的最后一块拼图——药品试验数据保护体系亟待完善。
现如今,在宏观层面我国已经成为全球第二大经济体,在全球创新药市场中地位也愈发重要;目光放到医药行业,数不清的中国同步开展国际多中心临床试验正在展开,越来越多的制药企业向全球性的原始创新进发。因此,与专利保护相匹配的药品试验数据保护制度的落实也愈发紧迫。
01
新药知识产权保护的“最后一块拼图”
众所周知,新药研发是一个风险高、投资大、周期长的过程,“一款新药=10年+10亿美金”的“双十定律”在制药界耳熟能详。因此,除了专利保护制度外,与鼓励创新相匹配的药品试验数据保护制度也亟待发布实施,以切实激励和保障企业持续创新,促进医药产业高质量发展。
对于创新药而言,临床试验取得预期结果并获批上市或许只是迈过了第一道门槛,商业化阶段的挑战只增不减。如果计算“净现值”,在药理研究、CMC和临床阶段,一款产品的净现值都还是负值,只有上市销售了,净现值才会向上提高。一位业内专家对E药经理人表示,通常企业进行研发投入决策的起点在于净收益,所以鼓励新药研发在前端是降低成本,到了后端就是让企业看到未来获益预期,这其中影响最深远的政策就是药品的定价支付和市场独占期。
通常意义上,针对创新药的市场独占期包括专利期、专利延长/补偿期和药品试验数据保护期等,同时针对儿科用药和罕见病用药也有特殊的市场独占期。其中试验数据保护期的确定性较强,专利期、专利延长/补偿期则与产品的创新性、专利体系等复杂的因素挂钩。可以看到,简化新药申请、专利链接制度、专利期补偿制度、首仿独占期等专利保护制度在我国已经得以落实,但是针对临床试验数据的保护制度尚未出台。
然而,临床试验不仅是新药研发过程中最重要、最“烧钱“的环节,还是产品注册分类中起到决定性作用的一环。
德勤发布的《抓住数字动力:衡量2022年药物创新的回报》显示,一款创新药的平均研发成本已经高达22.84亿美元,相较于十年前都增长了近一倍,并且仅临床试验周期(I期到-III期)就为6.74年,临床试验复杂化、难度加大是影响增长的主要因素。而在药物研发的过程中,临床试验费用占比高达60%~80%,如果是做全球多中心III期临床试验,每入组一个病人还需要再增加几万美元。
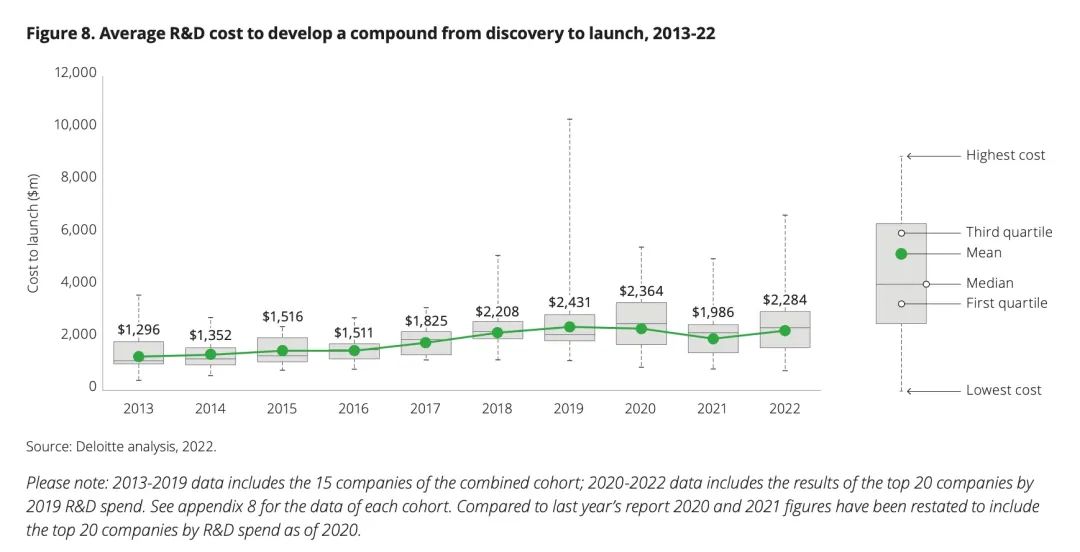
来源:德勤《抓住数字动力:衡量2022年药物创新的回报》
因此在美国,提交由“申请人自行取得或是委托他人取得”的药品临床试验安全性有效性数据成为FDA区分完整新药上市申请、参照药与改良新药、仿制药、生物类似药的简化上市申请的关键证据。上述专家指出,“数据保护关键是在数据,而不在于保护。用数据保护建立创改仿的市场秩序是美国药品注册路径的底层逻辑。”
FDA在1984年出台的Hatch-Waxman法案依据药品注册路径的不同给予了新化学实体(NCE)、全新的生物药实体(NBE)不同时长的保护周期。其中,NCE最长保护期达7.5年,NBE最长达12年,无论是NCE还是NBE,保护方式都为“不受理+不批准+不依赖”。“数据保护的逻辑就在于‘谁做原始的安全性有效性数据,谁拥有这个数据的所有权,谁就应该得到保护。’”
此外,根据市场环境的不同,除了美国外,欧盟、日本、韩国等市场都已建立了完善的药品试验数据保护制度,以赋予创新药企对于药品试验数据以一定期限市场独占权的方式保护创新,对改良新药也给予了数据保护期,并采用“不受理+不批准”的方式进行保护。
然而在我国,药品试验数据保护制度一直处于有总体规定但缺乏实施细则的“不落地”状态,影响了医药企业持续创新的积极性。
02
药品试验数据保护与专利纠纷早期解决机制有效衔接
事实上,早在2001年,我国成为WTO成员国后,TRIPS协议作为WTO成员国义务之一,第三十九条第三款就明确规定有义务对药品试验数据提供保护;同时,在其它多双边贸易协定,如中瑞贸易协定中,规定缔约双方应依据TRIPS协定,保护未披露药品试验数据,并规定自批准上市许可之日起至少6年内,禁止其他申请人依赖该未披露实验数据。2021年9月,中国正式申请加入《全面与进步跨太平洋伙伴关系协定》(CPTPP),该协定也包含对化学药品和生物制品的数据保护。以入世为基础,2002年施行的《药品管理法实施条例》第35条也规定了相关内容。
之后修改的《药品管理法实施条例》并未对该内容进行更新,也就是说,在行政法规的高度上,对药品试验数据予以保护已经明确。
药品试验数据真正未得以落实的其实是在执行层面,上述专家告诉E药经理人,“规则仍然很宽泛,第一没有限定期限,第二条款中‘不合理的商业使用’并没有详细说明,也未规定具体的措施。”
不过,药品试验数据保护已经渗透于我国药品审评审批制度改革的节奏中。在2017年中共中央办公厅、国务院办公厅发布的《关于深化审评审批制度改革鼓励药品医疗器械创新的意见》中再次明确“对创新药、罕见病治疗药品、儿童专用药、创新治疗用生物制品以及挑战专利成功药品注册申请人提交的自行取得且未披露的试验数据和其他数据,给予一定的数据保护期。”
基于此,国家药品监督管理局在2018年发布了《药品试验数据保护实施办法(暂行)(征求意见稿)》,就系统性制定药品试验数据保护制度向社会公开征求意见;2022年,国家药监局再次发布“公开征求《中华人民共和国药品管理法实施条例(修订草案征求意见稿)》意见”,将数据保护期统一设立为药品注册上市后6年。
然而至今,药品试验数据保护的详细规则仍高悬空中,保护范围、保护期限、保护方式等既无细则规定,也无相应流程规定,更是无法与专利纠纷早期解决机制形成有效衔接。一位业内律师举例,在药品专利纠纷早期解决机制的制度框架下,原研药企不得不从获得上市批件的那一刻起,就严防仿制药企的挑战。此前曾发生过仿制药在原研药获批后短时间内就提交上市申请的事件,而原研药企虽然最终赢得了专利诉讼,但之后仿制药的撤网成本仍然很高,不利于创新药市场环境的可持续发展。“药品试验数据保护制度具体实施办法的缺位,是导致该类案件发生的根源所在。”
因此,近年来,尽快落实药品试验数据保护制度,加强试验数据保护与专利保护相结合的机制得到业界多方呼吁。在全国两会期间,有代表建议,以2018年国家药品监督管理局发布的《药品试验数据保护实施办法(暂行)(征求意见稿)》为基础,以《中华人民共和国药品管理法实施条例》修订为契机,对药品试验数据保护的药品品种、期限、申请受理、公示、仿制药申请及批准管理等方面进行研判,出台具体实施办法及配套文件。

同时,针对生物制品,全国政协委员、复旦大学上海医学院副院长朱同玉在《关于完善我国药品试验数据保护制度的建议》中提出,将生物制品在中国开展的临床试验所取得的临床试验数据纳入药品试验数据保护范围;对不同类型的药品设定不同的保护期限,建议对生物药设立10-12年保护期,推动医药产业高质量发展。
“我国鼓励药品研发的动力其实是在于完整的知识产权保护制度体系,这不仅仅在专利层面,还包括药品试验数据保护,药品的全生命周期都需要知识产权来保护。”一位企业知识产权负责人指出,鼓励药物研发创新的知识产权保护应该区分数据保护和市场保护两个概念,这既能为更加聚焦重难点药品开发提供信心支持,也能使得我国的药品注册更加接轨国际。
本文作者可以追加内容哦 !

