3月11日,礼新医药官网显示,Claudin18.2ADC药物LM-302进入III期临床。

目前全球Claudin18.2 ADC研发有3家启动全球III期临床:信达生物的IBI343是全球首款进入三期临床阶段的Claudin18.2 ADC新药。近日,康诺亚生物/乐普生物的CMG901及礼新医药/Turning Point(BMS)的LM-302也公布进入III期临床。
Claudin 18.2
Claudins(CLDNs)为紧密连接()蛋白家族,能够连接细胞,形成细胞旁屏障。它们主要分布在胃、胰腺和肺组织中,可以用于疾病的诊断和治疗。CLDNs有四个跨膜结构域(s),NH2和COOH端位于细胞内,另有ECL1和ECL2两个胞外环。磷酸化位点在细胞质位点的C端。CLDN 18.2作为其中一种亚型,由261个氨基酸组成。
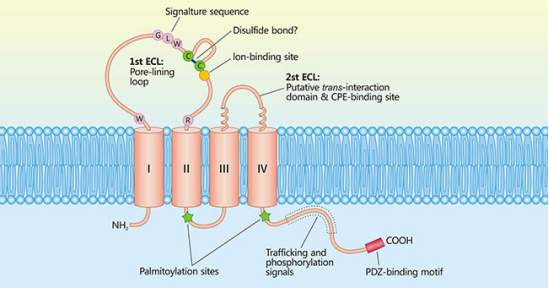
CLDN 18在正常组织中表达有限,CLDN18.1的表达仅限于肺部;而Claudin18.2仅在分化的胃粘膜上皮细胞中表达,但在各种原发性恶性肿瘤中广泛表达。这种在正常细胞无/低表达、在癌细胞高表达的特性使Claudin 18.2近年来成为实体瘤免疫疗法的理想靶点,受到研究人员的高度关注。
全球在研格局
热门靶点CLDN18.2,在国内外已经形成了十分激烈的研发环境。目前,已经开发了针对CLDN 18.2进行癌症治疗的多项免疫疗法,包括单克隆抗体、双特异性抗体(BsAbs)、CAR-T细胞和ADC疗法。
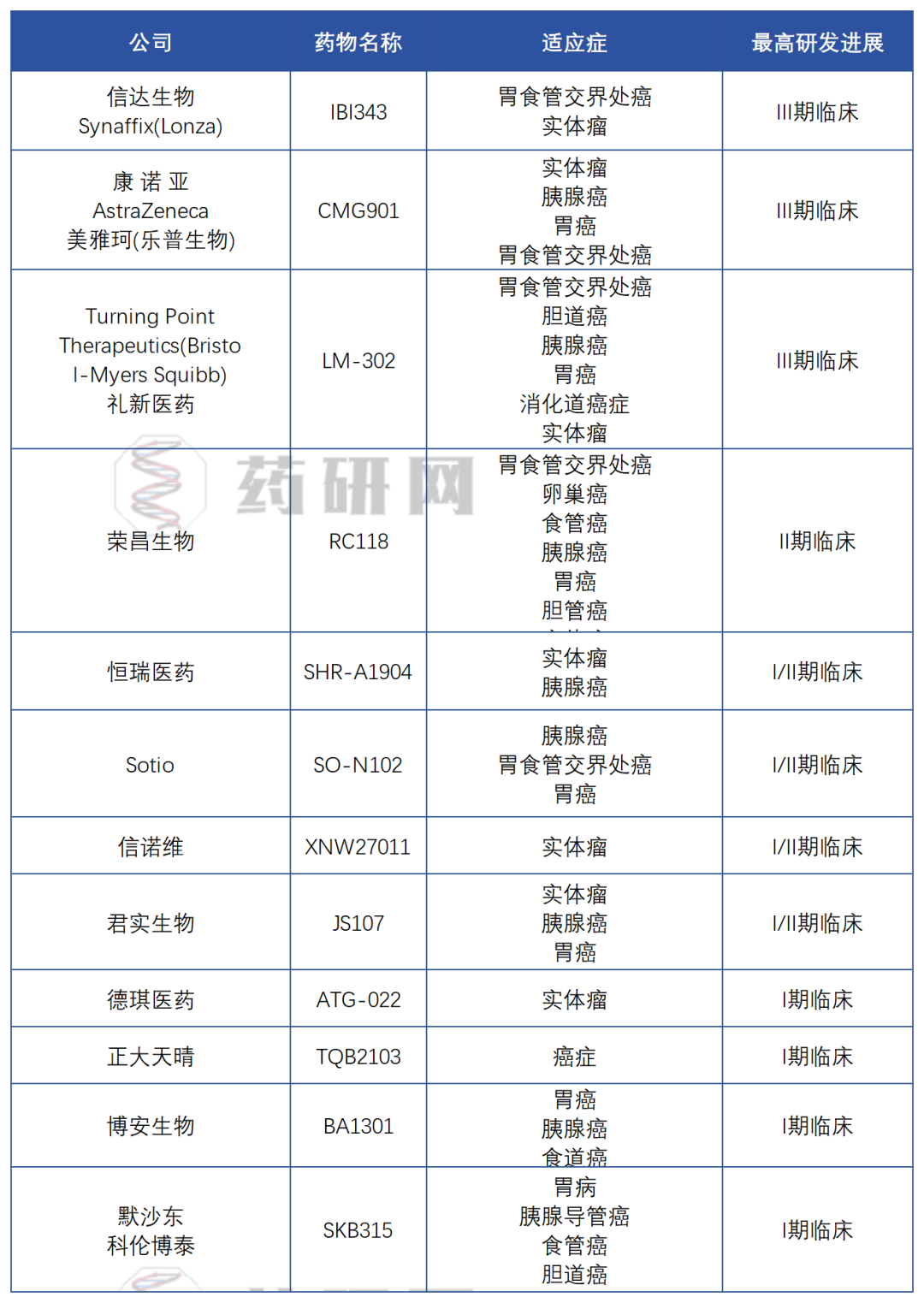
根据药研网团队统计,其中ADC药物类型的项目有12款已进入临床开发阶段。
目前全球Claudin18.2 ADC研发有3家启动全球III期临床:信达生物的IBI343是全球首款进入三期临床阶段的Claudin18.2 ADC新药。近日,康诺亚生物/乐普生物的CMG901及礼新医药/Turning Point(BMS)的LM-302也公布进入III期临床。
信达生物IBI343
2024年2月,信达生物在Clinicaltrials.gov网站注册了IBI343治疗Claudin18.2阳性、HER2阴性胃癌的三期临床试验,这也是全球首款进入三期临床阶段的Claudin18.2 ADC新药。
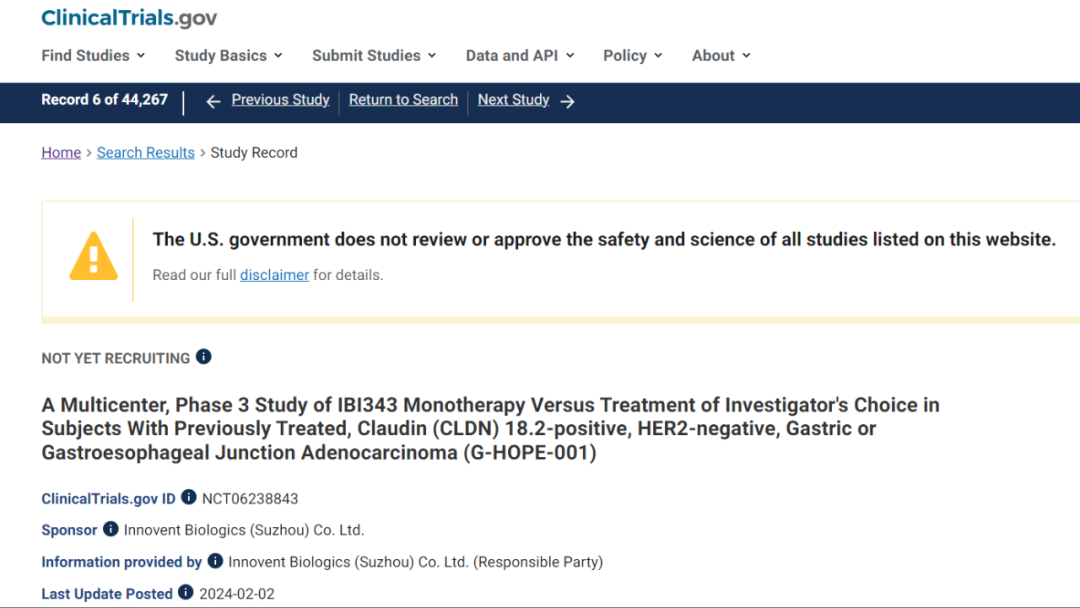
IBI343是重组人源抗CLDN18.2 ADC,与表达CLDN18.2的肿瘤细胞结合后,可发生CLDN18.2依赖性ADC内化,并释放毒素药物引起DNA损伤,导致肿瘤细胞凋亡。
IBI343采用差异化设计,ADC技术源自与Synaffix的合作,Glycan介导的顶点偶联,DAR=4,采用高内吞活性的抗体,进行了Fc Silence突变。体内活性比DAR=8的DXd-ADC更强,亲水性更好PK更好,强旁观者杀伤效应。
康诺亚/乐普生物CMG-901
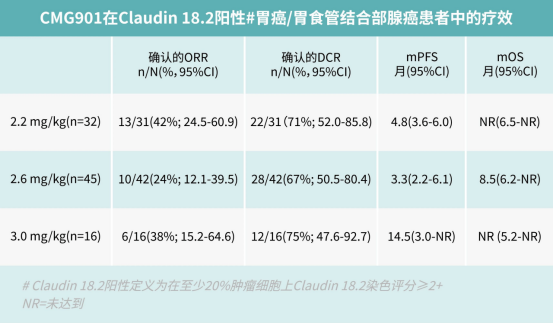
2024年3月7日,阿斯利康在药品临床试验登记与信息公示平台网站上注册了Claudin18.2 ADC新药AZD0901(CMG901)二线或二线以上治疗晚期或转移性胃癌的三期临床试验。

CMG-901是世界上第一个进入临床开发的CLDN 18.2 ADC,由靶向CLDN 18.2的人源化单抗CM311和微管聚合蛋白抑制剂MMAE 通过可裂解连接臂偶联而成。这款药物的抗体部分(CM311)可激活抗体依赖的细胞毒效应(ADCC)和补体依赖的细胞毒效应(CDC)协同杀伤肿瘤细胞。
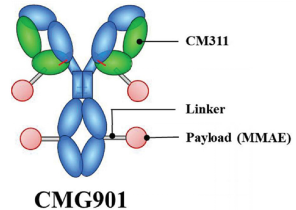
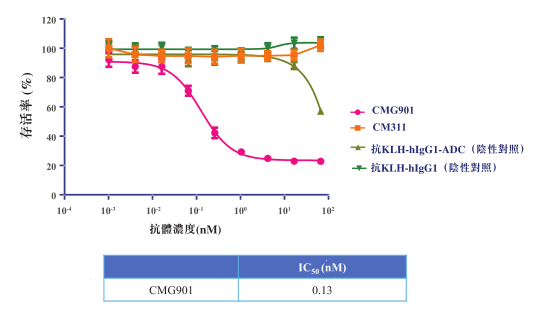
相对于单抗CM311,ADC在杀伤Claudin 18.2阳性肿瘤细胞方面的功效更为显著。
康诺亚的CMG-901是首个在中国及美国均取得临床试验申请批准的靶向CLDN18.2的全新重组人源化单克隆抗体偶联药物,由抗CLDN18.2单克隆抗体、可裂解的链接体和细胞毒性小分子单甲基澳瑞他汀 E(MMAE) 组成。CMG-901由KYM Biosciences Inc.所有,其是由康诺亚(70%所有权)和乐普生物(30%所有权)成立的合资企业,旨在共同开发、生产和商业化CMG-901。
2023年2月,康诺亚和乐普生物共同宣布与阿斯利康就CMG-901达成全球独家授权协议。根据许可协议,KYM Biosciences Inc.获得6300万美元的预付款和超过11亿美元的潜在额外研发和销售相关的里程碑付款,以及高达低双位数的分层特许权使用费。阿斯利康获得CMG-901研究、开发、注册、生产和商业化的独家全球许可。
礼新医药LM-302
3月11日,礼新医药官网显示,Claudin18.2ADC药物LM-302进入III期临床。

LM-302是一款礼新医药自主研发的靶向Claudin18.2的ADC,由Claudin18.2特异性抗体、可裂解连接子以及毒素载荷甲基澳瑞他汀E(MMAE)组成。LM-302能特异性靶向Claudin18.2阳性的肿瘤细胞并高效结合,之后借助抗体依赖的细胞毒性作用(ADCC),以及内吞进入细胞内溶酶体后释放毒素载荷等多种机制杀伤肿瘤细胞,从而起到抗肿瘤效果。
2022年5月4日,礼新医药授权Turning Point Therapeutics (已被BMS收购)在LM-302在全球除大中华区与韩国以外国家及地区的独家开发和商业化权益。

2023年10月27日,CDE官网公示,礼新医药申请的注射用LM-302拟纳入突破性治疗品种,拟定适应症为既往接受过二线及以上系统治疗的Claudin18.2阳性的局部晚期或转移性胃或胃食管交界处腺癌。目前,LM-302处于治疗Claudin18.2阳性晚期消化道肿瘤的3期临床阶段。
CLDN18.2作为胃癌重要靶点,药企必争,礼新在国内走在前列。同时,CLDN18.2也是为数不多的单抗成药的靶点。作为ADC的开发,同样值得期待。
关注wechat药研网
本文作者可以追加内容哦 !

