病毒性和酒精性肝病、药物性肝病、自身免疫性肝炎和原发性胆汁性肝硬化最终可发展为终末期肝病,在全球范围内已逐渐成为主要死因之一[1]。目前,针对终末期肝病已有多种治疗方法,包括药物、人工肝以及门静脉高压症的内窥镜和血管干预。尽管这些治疗在一定程度上缓解了临床症状,但由于肝细胞数量减少、肝功能减退,使疾病无法逆转[2]。目前,原位肝移植仍然是终末期肝病唯一有效的治疗方法[3]。然而,供体来源不足以满足临床需求。此外,移植后排斥反应和高昂的治疗费用限制了临床适用性[4]。因此,需要针对终末期肝病开发可替代治疗的策略。
肝细胞移植可作为肝移植的替代方法[5]。移植的肝细胞增殖以再生受损的肝脏并补偿肝功能的丧失。然而,肝细胞移植的实际应用受到供体细胞的可用性及其体外增殖潜力有限的限制。近年来,再生医学和干细胞的研究进展迅速。间充质干细胞 (MSCs) 是具有自我更新能力的多能细胞,可以分化成多个谱系 [6,7]。在国内外学者开展的临床前和临床试验中,利用间充质干细胞治疗肝病取得了重大进展[8]。
这篇综述主要围绕MSCs治疗肝病的作用机制和临床应用现状,并对MSCs的归巢过程和试图优化的各种策略进行了批判性讨论。本文可为今后MSCs的基础和临床研究提供参考。
o1
间充质干细胞治疗肝病的机制
间充质干细胞 (MSC) 移植作为原位肝移植的替代策略,已被证实用于治疗终末期肝病。尽管MSC移植的治疗机制尚不完全清楚,但越来越多的证据表明,MSCs可以通过促分化为肝细胞样细胞、免疫调节和抗纤维化机制来再生和自我更新以修复肝脏。以往的多项临床试验证实,间充质干细胞移植可恢复肝功能,减轻肝损伤。然而,全身给药后MSCs的低效归巢是MSC治疗的主要瓶颈,因此,给药后必须有足够数量的MSCs归巢到目标组织才能提高治疗效果。
间充质干细胞是源自中胚层的多能基质细胞,于1970年代首次在成人骨髓中发现[9]。MSCs可以从脂肪组织、肌肉、真皮、牙髓、滑膜、脐带、胎盘、绒毛膜、经血、母乳和羊水中分离出来 [10]。2006年,国际细胞与基因治疗学会提出了以下几个定义MSCs的最低标准:
(1)在标准培养条件下,细胞具有塑料贴壁性;(2)细胞必须表达特定的细胞表面标志物,如CD73、CD90和CD105;(3)细胞缺乏典型的造血标志物如CD45、CD34、CD14/CD11b、CD79a/CD19或人白细胞抗原-DR同种型的表达;(4)细胞可以使用适当的培养基进行三向分化成软骨细胞、脂肪细胞或成骨细胞。
在适当的体外培养条件下,可以诱导MSCs 最终分化成多个谱系。它们可以再生骨骼、脂肪细胞、内皮细胞、肌肉细胞和神经元,展示了用于再生医学的潜力[11]。MSCs是低免疫原性的,因为它们缺乏II类主要组织相容性抗原并表达低水平的I类主要组织相容性分子。此外,MSCs不表达对免疫识别很重要的共刺激分子,如CD40、CD80和CD86 [12]。为了阐明MSC在治疗肝病中的积极作用,我们简要概述了基于MSC的疗法的机制,如图1所示。表1总结MSCs调节其他细胞的细胞内信号通路。
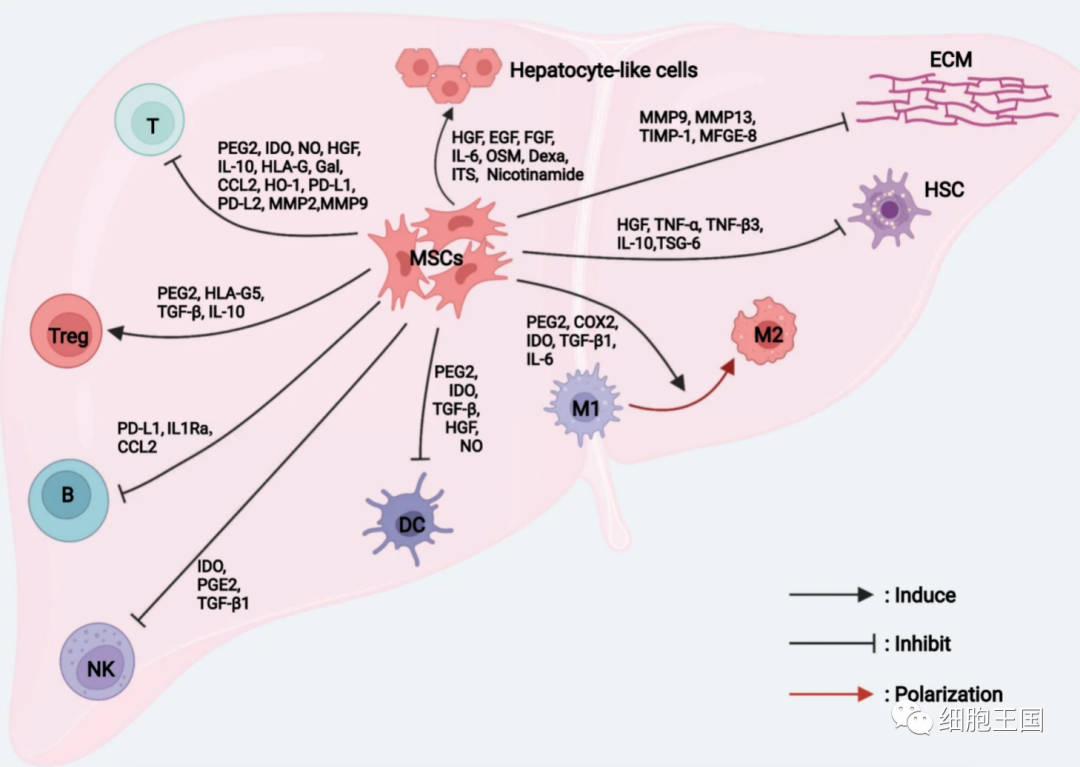
间充质干细胞治疗肝病的机制。间充质干细胞通过分化、免疫调节和抗纤维化作用修复受损的肝组织。名词解释:HSC,肝星状细胞。ECM细胞外基质、M1经典激活巨噬细胞、M2交替激活巨噬细胞、DC树突状细胞、NK自然杀伤细胞、B B淋巴细胞、Treg调节细胞

表1 MSCs调节其他细胞的细胞内信号通路总结
o2
MSCs分化为肝细胞样细胞
源自MSCs的肝细胞样细胞是有望用于肝脏再生的细胞来源。张等人检测脐带间充质干细胞移植后四氯化碳诱导的肝纤维化/肝硬化大鼠肝组织中人白蛋白(ALB)、甲胎蛋白(AFP)、CK18和CK19的表达水平,证实了移植细胞分化为未成熟肝细胞(上皮样细胞),然后动态分化成熟为肝细胞样细胞 [21]。
当与生长因子或细胞因子如肝细胞生长因子 (HGF)、表皮生长因子 (EGF)、成纤维细胞生长因子 (FGF)、白细胞抑制剂、IL-6、制瘤素 M (OSM) 、地塞米松 (Dexa)、烟酰胺和胰岛素转铁蛋白硒 (ITS)等一起培养时,MSC可以分化成肝细胞样细胞 [22]。
MSCs分化的肝细胞样细胞可以作为功能性干细胞吗?
大仓等人发现从脂肪来源(AD)-MSCs分化的肝细胞样细胞表现出肝细胞的功能特征,包括ALB的表达,尿素的分泌,细胞色素P450的活性,低密度脂蛋白的摄取和糖原的储存[23]。然而,坎帕德等人发现从UC-MSCs分化而来的肝细胞样细胞缺乏肝细胞石蜡1、肝细胞核因子4等各种肝脏标志物,表明它们没有达到成熟肝细胞的水平[24]。值得注意的是,从MSCs转分化的肝细胞样细胞仅占肝脏总体积的一小部分。因此,应开发更有效的促进肝组织分化的方法,以增强MSCs治疗肝病的疗效。
o3
间充质干细胞的免疫调节能力
受损肝组织中的免疫失调被认为是纤维化和肝功能衰竭的主要原因。最近的研究表明,间充质干细胞通过先天性和适应性免疫反应的细胞间接触或旁分泌调节发挥免疫调节活性。
巨噬细胞在先天免疫中起重要作用。M1/M2极化的不平衡是肝损伤和纤维化的关键。一般来说,MSCs倾向于抑制M1(促炎亚型)并诱导M2(抗炎亚型),从而促进炎症消退和组织再生。活化的MSC通过前列腺素E2 (PGE2)、吲哚胺-2、环氧合酶2 (COX2)、3-双加氧酶 (IDO)、TGF-1和IL-6促进M2型单核细胞 (M0) 极化 [25 , 26 , 27]。李等人研究表明 BM-MSCs通过促进Hippo信号通路介导巨噬细胞极化重编程为抗炎M2表型[13]。树突状细胞(DC)是先天免疫系统的主要成分,它们处理呈递给T细胞的抗原。MSCs抑制DCs的分化、成熟和迁移,这是由MSCs分泌的PGE2、IDO、HGF、TGF-和一氧化氮 (NO) 等可溶性因子介导的[28 , 29 , 30]。自然杀伤 (NK) 细胞在针对入侵病原体的一线免疫防御、肝脏炎症的调节和循环淋巴细胞的募集中发挥关键作用。斯帕贾里等人证实MSCs可以通过分泌IDO和PGE2来抑制NK细胞 [31]。此外,间充质干细胞可通过分泌TGF-1,抑制NK细胞体外细胞毒性,有效降低丙氨酸氨基转移酶和促炎细胞因子的水平,减少细胞浸润和肝脏中的炎症细胞 [32]。
T淋巴细胞和B淋巴细胞是适应性免疫的主要参与者。如上所述,MSCs通过抑制DC成熟来降低T细胞活化。MSCs还显著抑制活化T细胞的增殖,主要是通过在细胞G0/G1周期阻断T细胞,而不是通过诱导T细胞凋亡 [33]。研究表明,MSCs对T细胞增殖和活化的抑制作用是通过分泌多种可溶性分子如NO、PGE2、IDO、HGF、IL-10、人白细胞抗原-G(HLA-G)、半乳凝素 (Gal)、CC趋化因子配体2 ( CCL2 )、血红素加氧酶 1 (HO-1)和TGF - 1 [34、35、36、37]。MSCs分泌的PD-L1和PD-L2还可以抑制CD4+ T细胞活化并诱导不可逆的T细胞低反应性[38]。MSCs分泌的基质金属蛋白酶 (MMPs),特别是MMP2 和MMP9,也通过下调响应性T细胞表面的CD25表达来促进MSCs的抑制活性 [39]。柳等人表明MSC通过LKB1-AMPK-mTOR通路抑制CD25翻译来抑制T细胞 [14]。此外,张等人发现人胎盘(hP)-MSCs可以通过调节Nrf2和NF-B信号通路之间的串扰来抑制 CD4+IL-10+T 细胞中PD-1的表达并减轻移植物抗宿主病小鼠模型中的肝损伤[15]。
调节性T细胞 (Tregs) 在急性肝炎期间抑制免疫细胞介导的肝细胞损伤方面发挥着至关重要的作用[40]。严等人发现与MSCs共培养的Tregs诱导更强的免疫抑制,这可能是由MSCs分泌的IL-10介导的[41]。Toll样受3和受体4在MSCs中高表达,可通过Notch信号通路诱导Tregs分化[16]。此外,许多可溶性因子(如PGE2、HLA-G5和TGF-)也在 MSCs 诱导的 Tregs 分化中发挥重要调节作用,从而抑制免疫细胞活化 [42]。B淋巴细胞通过呈递抗原和作为抗体产生细胞参与维持适应性和体液免疫。间充质干细胞可以抑制B细胞的分化、增殖、活化和抗体产生 [43]。MSCs衍生的CC趋化因子配体2 (CCL2) 通过抑制 STAT3激活和诱导配对box5表达来抑制B细胞增殖和B细胞中的抗体产生[44]。MSC衍生的白细胞介素1受体拮抗剂 (IL1Ra) 和PD-L1抑制B细胞的分化并诱导巨噬细胞向M2表型极化 [45 , 46]。
本文作者可以追加内容哦 !

