
孤儿药是治疗罕见疾病的药物。
•在全球范围内,大约存在5000-8000 种已知罕见疾病,影响了大约 3.5亿人, 中国的罕见病患者数量大约超过2000万名。其中只有大约 10% 的疾病有治疗方法。
•在已知的6千多种罕见疾病中,癌症占据了11.1%,传染性疾病约占2.6%。72%的罕见疾病属于遗传性疾病,其余由感染、过敏、环境或罕见癌症造成。
FDA对孤儿药的定义为:“用于治疗、预防或诊断在美国影响不到20万人的罕见疾病的药物”(不到620例/百万人),欧洲为500例/百万人,日本为400例/百万人,中国为100例/百万人。

为了解决罕见病患者群体在药物研发、生产和销售方面面临的问题,以促进更加公平和有效的医疗保障,美国1983年颁布的《孤儿药法案Orphan Drug Act》,授权获得美国孤儿药资格认定的药物可以享受新药获批上市后7年市场独占权、免除NDA/BLA申请费、可能免除部分临床数据的申报要求、临床研究费用50%税收减免等一系列加速审评及特别扶持政策。

近年来,孤儿药占FDA所有新批准的药物和生物制剂的比例越来越大,2018年、2020年、2021年及2023年比例均超过了50%,自 1983 年至 2023 年底,FDA 共批准上市了1080款孤儿药。据预测,2019年至2024年,全球孤儿药市场正以约12%的复合年增长率增长,增速约为非孤儿药市场的两倍,至2024年,其市场规模将达到2420亿美元,约占全球处方药销售额的20%。
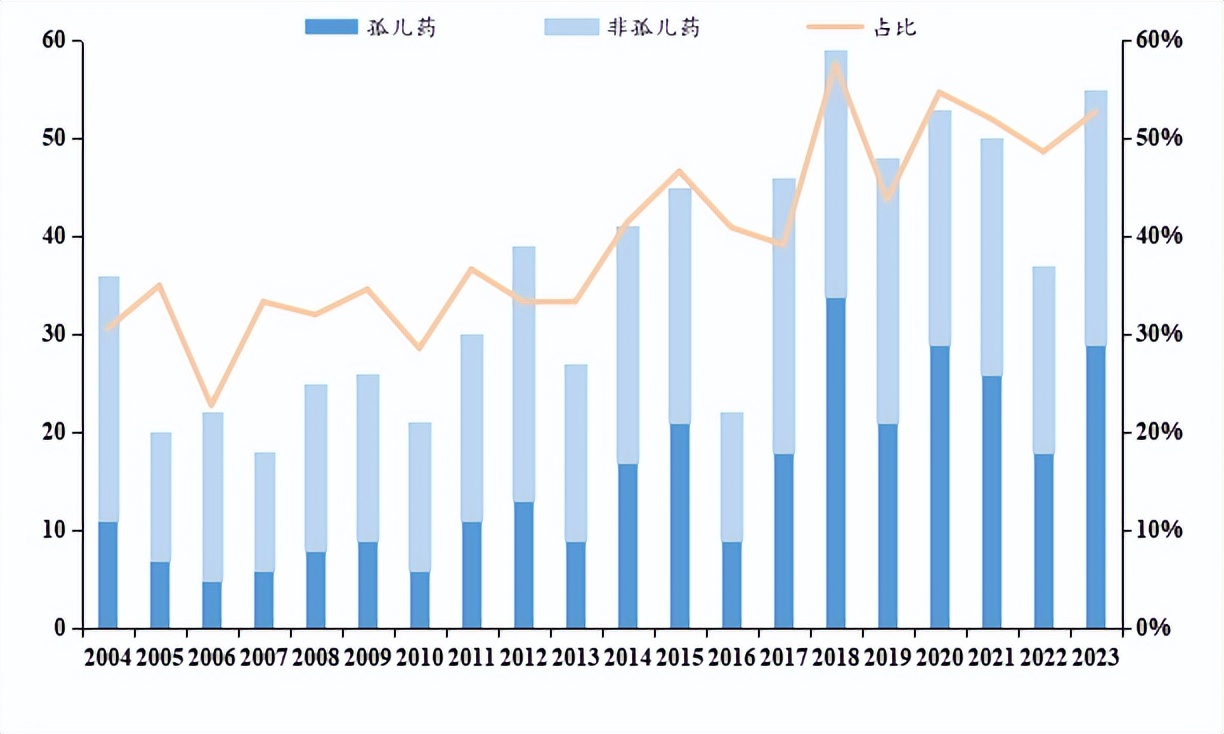
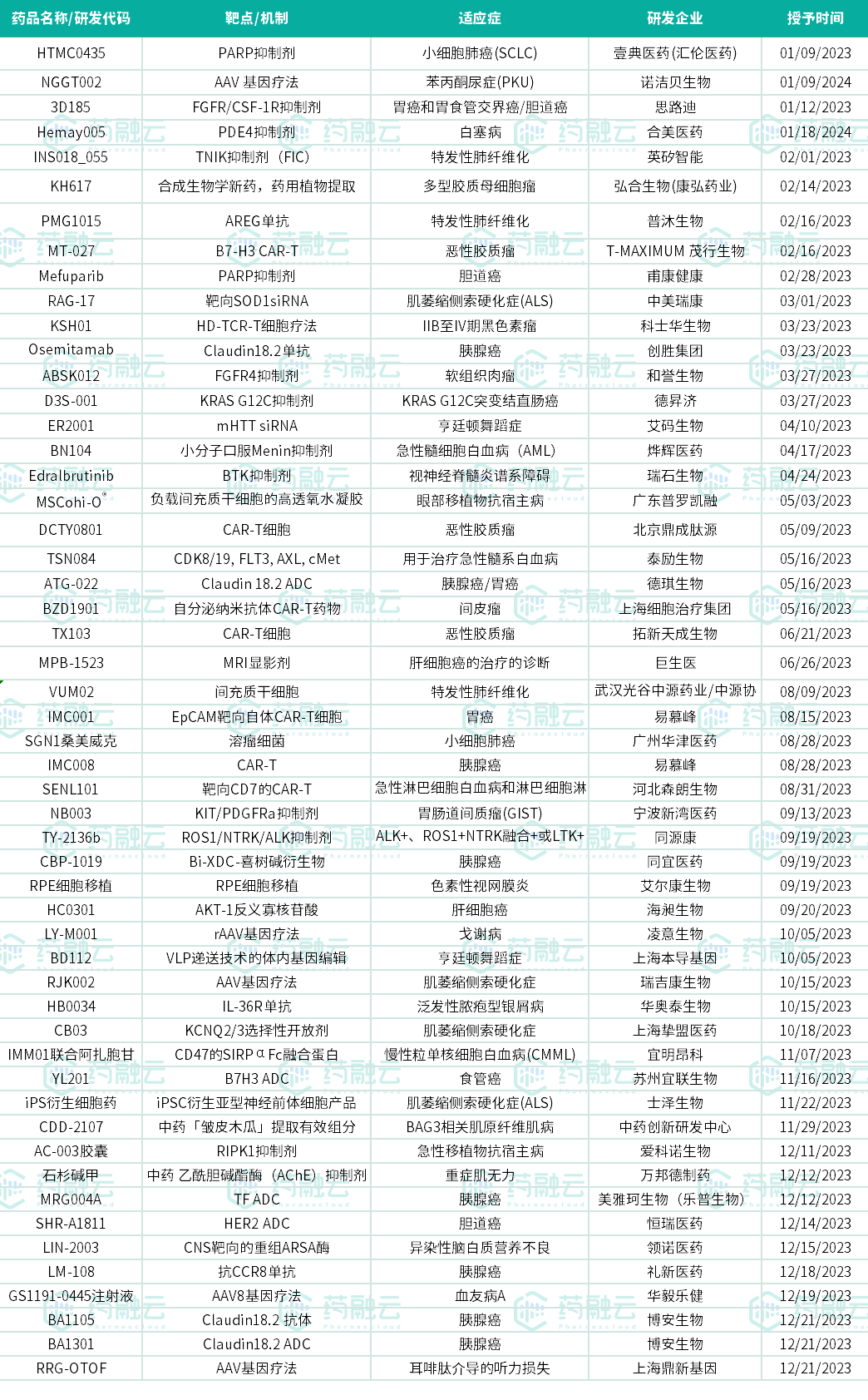
2023年获得FDA授予的孤儿药认定的创新药共有376种,其中中国的创新药占53种(按品种计),约占14%。其中$博安生物(HK|06955)$2款产品针对适应症均获得孤儿药资格认定——靶向Claudin18.2创新抗体BA1105和ADC BA1301;易慕峰靶向EpCAM的自体CAR-T细胞注射液IMC001胃癌和两项适应症前后获得FDA孤儿药资格认定;$德琪医药-B(HK|06996)$自主研发的Claudin 18.2 ADC ATG-022胃癌及两项适应症先后获FDA授予孤儿药资格。
从药物类型来看,不乏创新性的基因疗法、CAR-T、siRNA、ADC等形式,热门靶点包括Claudin 18.2、PARP、B7-H3等。适应症多集中在肿瘤领域,、胃癌、恶性胶质瘤等适应症布局企业较多。
结语
孤儿药,作为治疗罕见疾病的独特药物,近年来在全球医药领域崭露头角。随着技术的日新月异,孤儿药的研发取得了令人瞩目的进展,新药数量逐年攀升,药物类型和适应症也愈发丰富多样。基因疗法、CAR-T、siRNA等前沿技术的融合应用,为孤儿药的发展注入了源源不断的创新活力。孤儿药,已然成为罕见病患者心中的希望之光,为全球患者带来福音。
<END>

本文作者可以追加内容哦 !

