HER2赛道的ADC一直被“诟病”内卷,但对于绝对“王者”的德曲妥珠单抗(优赫得,Enhertu),早已超越后来者一大截。
4月6日,阿斯利康官网消息,美国FDA已经加速批准HER2靶向ADC 德曲妥珠单抗,用于治疗不可切除或转移性HER2阳性(免疫组化[IHC] 3+)实体瘤成年患者。
本次加速批准主要基于三项临床II期试验——DESTINY-PanTumor02、DESTINY-Lung01和DESTINY-CRC02的研究结果。
德曲妥珠单抗也是首个获得FDA批准的不限癌种的ADC疗法,让其构筑的适应证“围墙”更加坚固,成为竞争对手更加无法超越的存在。
据悉,德曲妥珠单抗目前在全球已获批用于乳腺癌、非小细胞肺癌、胃癌三大癌种、五项适应证,除了本次获批的不限癌种适应证外,还包括:
用于治疗既往接受过(或一种或多种)抗肿瘤治疗的不可切除或转移性 HER2 阳性乳腺癌成年患者;
用于治疗接受过治疗的不可切除或转移性HER2低表达乳腺癌成年患者;
用于治疗携带HER2突变的不可切除或转移性非小细胞肺癌成年患者;
用于治疗局部晚期或转移性HER2阳性胃或胃食管交界处 (GEJ) 腺癌的成年患者。

图源:AZ官网
2023年,得益于德曲妥珠单抗携HER2阳性晚期乳腺癌二线治疗和HER2低表达晚期乳腺癌两个适应证登陆更多市场,其销售额也一路水涨船高。不断拓展的适应证与市场范围让德曲妥珠单抗成为全球增速最快的ADC之一,根据AZ与第一三共共同披露的数据计算,2023年销售额超25亿美元,较2022年几乎翻倍。
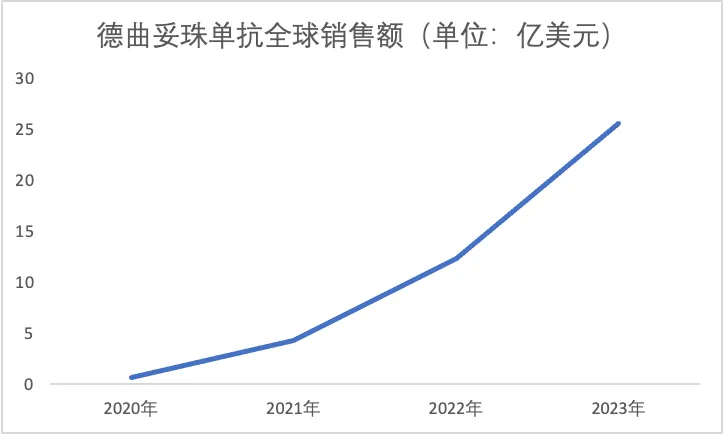
图源:AZ/第一三共财报
全球知名分析机构GlobalData还预测,到了2029年,第一三共或将以超百亿美元的销售额成全球ADC领域的“药王”,并且将是第二名Seagen的两倍。
而自2021年,德曲妥珠单抗在乳腺癌领域头对头成功挑战罗氏的Kadcyla(恩美曲妥珠单抗)之后,后者的销售额表现就一直乏力,到2023年已经略微下滑,从20.8亿瑞士法郎(约23亿美元)下滑到19.66亿瑞士法郎(约22亿美元)。
值得一提的是,2013年首次获得FDA批准的恩美曲妥珠单抗,用了五年的时间才跨入10亿美元俱乐部,而2019年首次获批的德曲妥珠单抗,五年就跨入了20亿美元俱乐部。

图源:第一三共官网
此外,AZ/第一三共还在进一步开发德曲妥珠单抗的更多潜力。从第一三共官网披露的信息来看,德曲妥珠单抗还有近20项临床试验正在开展,横跨临床I期到III期的乳腺癌、肺癌和胃癌三大癌种。
当然,德曲妥珠单抗并非在HER2 ADC领域毫无挑战者,这一靶点其实拥有非常广阔的开发空间。例如国内企业科伦博泰的A166,除了HER2乳腺癌和胃癌外,还在攻克尿路上皮癌、结直肠癌等多个领域;恒瑞的SHR-A1811治疗HER2阳性晚期结直肠癌的适应证也在去年被纳入了突破性治疗品种;石药的DP303c也在开展针对巢癌的临床试验;去年被百济神州“退货”的Zymeworks的zanidatamab则是针对HER2+胆道癌患者。
本文作者可以追加内容哦 !

