癌症免疫疗法已经改变了治疗的可能性,但其有效性在患者之间存在显著差异,表明存在其他免疫逃逸途径。
2024年4月12日,复旦大学许杰团队在Cell 在线发表题为“ITPRIPL1 binds CD3 to impede T cell activation and enable tumor immune evasion”的研究论文,该研究发现ITPRIPL1作为CD3的抑制配体,其表达抑制肿瘤微环境中的T细胞。
ITPRIPL1胞外结构域与T细胞CD3的结合显著降低了钙内流和ZAP70磷酸化,阻碍了T细胞的初始活化。在各种实体瘤类型的小鼠模型中,使用针对ITPRIPL1的中和抗体治疗可抑制肿瘤生长并促进T细胞浸润。以犬ITPRIPL1为靶点的抗体对宠物临床中自然发生的肿瘤具有显著的治疗效果。这些发现强调了ITPRIPL1(或CD3L1, CD3配体1)在关键的“信号一”阶段阻碍T细胞激活的作用。这一发现将ITPRIPL1定位为针对多种肿瘤类型的有希望的治疗靶点。

免疫检查点阻断(ICB)的出现显著地重塑了临床肿瘤学的景观。特别是,抗PD-L1 /PD-1治疗作为一种流行的免疫治疗方式,在多种恶性肿瘤中获得了显著的成功。然而,相当一部分患者对现有的免疫疗法继续表现出耐药性或有限的反应性,这是一个持续的临床挑战在肿瘤微环境(TME)中,复杂的因素被认为与免疫反应的衰减有关。值得注意的是,T细胞的功能障碍可能会显著阻碍免疫治疗的疗效,尽管其确切的潜在机制尚不清楚。广泛的努力正在进行中,以解决与肿瘤特异性T细胞毒性相关的障碍。T细胞受体(TCR)-CD3复合物在T细胞应答启动中起核心作用,由/或/异源二聚体(TCR)、CD3/CD3异源二聚体、CD3/CD3异源二聚体和CD3同源二聚体组装而成。值得注意的是,在这个8个亚基复合物中,CD3贡献了两个相同的细胞外结构域(ECDs),并代表了几个抗体克隆(包括OKT3和UCHT1)的靶标,它们具有调节T细胞功能的能力。先前的研究主要集中在主要组织相容性复合体(MHC)肽作为TCR-CD3复合体的激活配体,从这些研究中获得的见解在塑造肿瘤疫苗,TCR-T和其他免疫疗法的发展中发挥了关键作用。然而,在先前的报道中,明显缺乏对该复合物具有抑制能力的天然配体的信息。
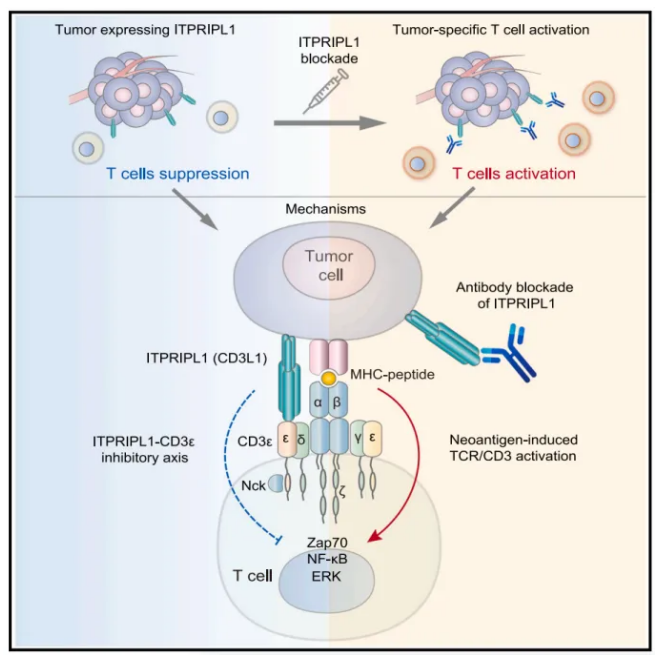
机理模式图(图源自Cell )ITPRIPL1是一种功能未知的I型膜蛋白,在各种人类癌症中表现出正常的富集表达和广泛的过表达。ITPRIPL1具有独特的ECD,在PD-L1低表达或无表达的肿瘤中尤其普遍。该研究深入探究了ITPRIPL1通过CD3抑制T细胞活化的机制,并发现Nck/ ZAP70是参与信号传导的关键分子。结合开发的抗itpripl1单克隆抗体,以及ITPRIPL1-CD3-NckZAP70-ERK/NF-kB调控的结构和构象变化等可能成为有希望的药物靶点。该研究已经提供了在各种临床前模型中使用人源化中和ITPRIPL1单克隆抗体作为抗肿瘤药物的原理证明数据。因此,有理由提出靶向ITPRIPL1可能是高水平表达ITPRIPL1肿瘤患者的有益临床选择。原文链接:https://www.cell.com/cell/abstract/S0092-8674(24)00310-6
本文作者可以追加内容哦 !

