6月10日,FDA外周和中枢神经系统药物咨询委员会(PCNS)就礼来开发的阿尔茨海默病药物Donanemab(多纳单抗)开会讨论,11:0全票支持Donanemab的有效性,对于ARIA副作用等问题,同样11:0投票认为获益大于风险。
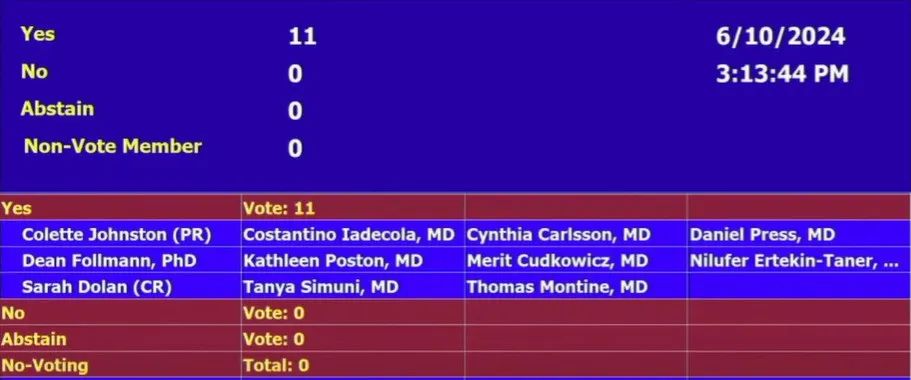
虽然FDA不必遵循咨询委员会的建议,但今天会议一致性的投票结果增加了donanemab获批准的可能性,为该药物的上市批准铺平了道路,更为早期阿尔茨海默病患者带来了新的希望。FDA通常在咨询委员会召开后1-2个月做出监管决定。
Donanemab是一款针对AD病理蛋白(A蛋白)的IgG1单克隆抗体,能够与AD患者大脑中沉积中的A结合,从而促进患者大脑中致病蛋白的清除,改善患者症状,减缓疾病进展。

Donanemab治疗早期症状性阿尔茨海默病的TRAILBLAZER-ALZ 2是一项随机、双盲、安慰剂对照的III期临床试验,评估了该药物在60-85岁早期症状性阿尔茨海默病患者中的安全性和有效性,共入组了1736患有早期症状性阿尔茨海默病以及类淀粉蛋白和tau病理的参与者,按照其tau水平,分为低-中等tau组或高tau组(疾病进展的后期病理阶段)。
在 donanemab 的关键 3 期试验中,tau 水平低至中度的患者似乎获得了最大获益。根据 iADRS(综合阿尔茨海默病评定量表)的衡量病情减缓了 35%, 根据 CDR-SB(临床痴呆评定量表-总计分)的传统评价表病情减缓了 36%。(见下图),研究结果显示,该药物显著减缓了认知能力的下降。

此外,参与者在日常活动能力方面的下降减少了40%,疾病进展风险降低了39%。不过,试验也暴露了Donanemab的一些副作用,包括24%的参与者出现脑肿胀,31%出现微出血,且在约1.6%的病例中,这些副作用是致命的,导致了3名患者的死亡。
据FDA官网发布的会议文件,对Donanemab的评估非常详细,重点关注了该药物的安全性和有效性。委员会认为Donanemab的好处超过了其风险,并认为礼来公司提供的数据证明了药物的有效性。在讨论中,专家们指出,尽管Donanemab存在风险,但这些风险是可以管理的,并且不应该阻碍药物的批准。
礼来公司股价上涨了 2%,市值超过8400亿美元!

FDA的审查
FDA对Donanemab的决定已经被推迟两次,但咨询委员会的投票是一个关键转折点,可能为礼来公司三十年来开发减缓痴呆症药物的努力带来积极结果。
礼来公司仍在对该药物继续进行临床研究,如TRAILBLAZER-ALZ 3,该研究旨在预防阿尔茨海默病的发生。
咨询委员会的投票结果为Donanemab的批准铺平了道路,尽管存在一些安全性和适用性的问题,但专家们普遍认为这些可以通过适当的管理和指导来解决。如果获得批准,Donanemab将与Leqembi竞争,后者2023年获得FDA有条件批准上市,并且于2024年获得中国药监局批准。
End
本文作者可以追加内容哦 !

