震撼真相:GLP-1 /司美格鲁肽心血管疾病防治的新星,独立于减重降糖的直接神效, FDA已批准司美格鲁肽用于心血管疾病
近年来,随着各类GLP-1受体激动剂临床试验结果的公布,越来越多的人开始关注这些药物在心血管保护方面的潜力。尤其是在今年5月8日,美国食品药品监督管理局(FDA)正式批准了司美格鲁肽(商品名:Wegovy)用于心血管疾病的治疗。
““Wegovy现在是首个获批用于帮助预防心血管疾病成年患者中危及生命的心血管事件的减肥药物,”FDA药品评估与研究中心糖尿病、脂质紊乱及肥胖科主任John Sharretts医学博士说道。“这一患者群体的心血管死亡、心脏病发作和中风风险较高。提供一个经过验证可以降低这种心血管风险的治疗选项,是公共健康领域的一项重大进步。”
但大众普遍认为,只要减重和降糖,就能减少心血管疾病的发生,没有什么特别的,我只要控制体重了,控制血糖了,不用这个药也行。然而,事情并没有那么简单。实际上,GLP-1受体激动剂在心血管保护方面的作用远超减重和降糖带来的间接好处。今天,我们将揭示司美格鲁肽(Semaglutide)在心血管保护中的多重直接作用,为您带来全新的视角。
近日,《国际分子科学杂志》发表了一篇题为《肽类将是未来的心脏保护药物:胰高血糖素样肽-1受体激动剂心脏保护作用的受体和信号机制》的综述文章[1]。这是俄罗斯科学家对近年来GLP-1受体激动剂心血管保护作用研究进展的系统梳理。文章指出,2型糖尿病治疗药物GLP-1类似物不仅可以控制血糖、体重,更重要的是可以通过激活心血管组织的GLP-1受体,多途径、多环节直接保护心血管,包括抑制心肌细胞死亡,改善心肌能量代谢,减轻炎症和氧化应激等,由此可显著改善心梗、心衰等心血管疾病的预后。这无疑为当前GLP-1类似物的心血管获益机制研究指明了方向,有望推动全新的心血管疾病防治策略的诞生。
文章出处: Boshchenko, A.A. et al. Peptides Are Cardioprotective Drugs of the Future: The Receptor and Signaling Mechanisms of the Cardioprotective Effect of Glucagon-like Peptide-1 Receptor Agonists. International Journal of Molecular Sciences. 2024, 25(9):4900.
近年大量研究表明,GLP-1受体激动剂不仅可通过减轻体重等间接途径,更重要的是能够直接作用于心血管,多途径、多环节地减轻心血管损伤:
这些研究进展有望推动以GLP-1为基础的全新心血管疾病防治策略和药物的开发。需要强调的是,GLP-1类似物的减重效应与其直接的心血管保护作用可能是并行不悖、相辅相成的。
近日,《国际分子科学杂志》发表了一篇题为《肽类将是未来的心脏保护药物:胰高血糖素样肽-1受体激动剂心脏保护作用的受体和信号机制》的综述文章[1]。这是俄罗斯科学家对近年来GLP-1受体激动剂心血管保护作用研究进展的系统梳理。文章指出,2型糖尿病治疗药物GLP-1类似物不仅可以控制血糖、体重,更重要的是可以通过激活心血管组织的GLP-1受体,多途径、多环节直接保护心血管,包括抑制心肌细胞死亡,改善心肌能量代谢,减轻炎症和氧化应激等,由此可显著改善心梗、心衰等心血管疾病的预后。这无疑为当前GLP-1类似物的心血管获益机制研究指明了方向,有望推动全新的心血管疾病防治策略的诞生。
一、GLP-1及其受体激动剂的发现
胰高血糖素样肽-1(GLP-1)是肠道L细胞分泌的一种肽类激素,通过与胰岛细胞上特异性的GLP-1受体结合,刺激胰岛素合成和分泌,抑制胰高血糖素的释放,从而发挥降血糖作用。此外,GLP-1还可抑制胃排空和食欲,有助于控制体重。内源性GLP-1极易被二肽基肽酶4(DPP-4)降解,半衰期不足2分钟。为了发挥稳定的降糖效果,科学家开发出了半衰期更长的GLP-1类似物,如艾塞那肽(exendin-4)、利拉鲁肽、度拉糖肽等。它们与内源性GLP-1具有相似的氨基酸序列,可特异性激活GLP-1受体,但能够抵抗DPP-4的降解。
除了胰岛,GLP-1受体在包括心血管在内的多个组织中广泛分布。因此,科学家推测GLP-1及其类似物除了降糖,还可能对心血管产生直接保护作用。大量动物实验和临床研究也证实,GLP-1类似物可显著减轻心肌梗死面积,改善心梗和心衰患者的心脏功能和预后,这在一定程度上独立于其降糖效果[2,3]。这意味着,GLP-1信号通路可能存在特异性的心血管保护机制。
二、动物实验证据:GLP-1类似物可直接保护缺血心肌
在啮齿类动物建立的心肌缺血-再灌注损伤模型中,无论是在缺血前给予还是再灌注时给予GLP-1类似物,都可明显减轻心肌梗死面积,改善心脏收缩和舒张功能。Bose等研究发现,在大鼠离体心脏持续灌注GLP-1 30分钟后再阻断冠脉,梗死面积可减少45%[4]。该保护作用被GLP-1受体拮抗剂 exendin(9-39)所消除,证实是通过激活心脏GLP-1受体实现的。在小鼠体内实验中,缺血前皮下注射利拉鲁肽,可使梗死面积减少20-40%[5]。长期给药可进一步改善心梗小鼠的存活率。更有研究表明,在冠脉结扎后给予艾塞那肽,仍可使梗死面积减少50%左右,提示其对缺血心肌也有一定的挽救作用[6]。
GLP-1类似物的心脏保护效应呈剂量依赖性,但并非剂量越大保护作用越强。一般情况下艾塞那肽1-5g/kg即可产生显著的心肌保护效果[7,8]。值得一提的是,艾塞那肽等GLP-1类似物在体内半衰期较长,单次给药即可缓释数小时至数天,在发挥心脏保护作用的同时也有助于控制血糖。相比之下,内源性GLP-1和缩短型类似物GLP-1 (9-36) 虽然在离体心脏灌流时也能减轻梗死面积,但体内应用受其极短的半衰期限制[9]。
三、GLP-1信号通路缓解心肌损伤的多重机制
那么,GLP-1类似物如何直接保护缺血-缺氧心肌细胞呢?总结现有的实验证据,主要包括以下几个方面:
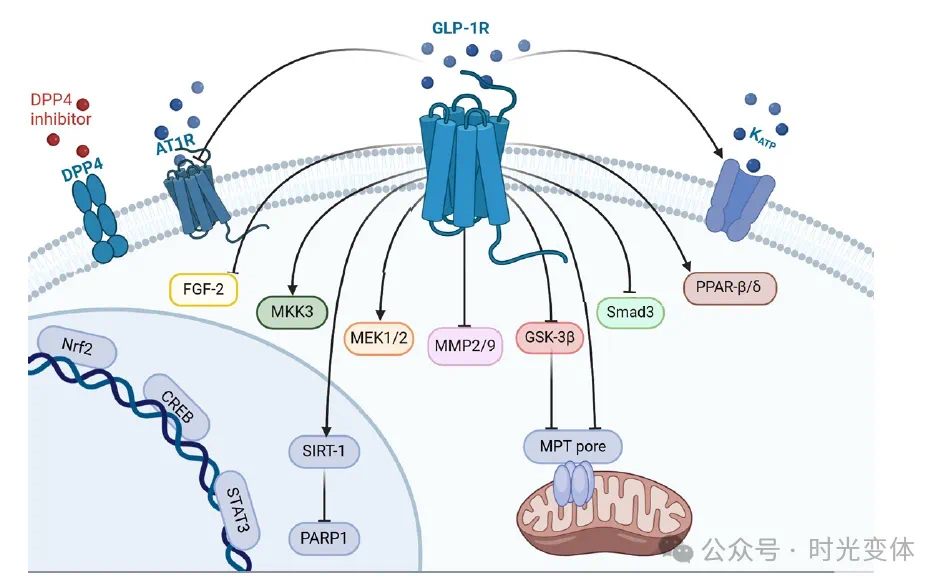
如图1所示,GLP-1受体激动剂可通过多种机制减轻心肌梗死后的重构过程:
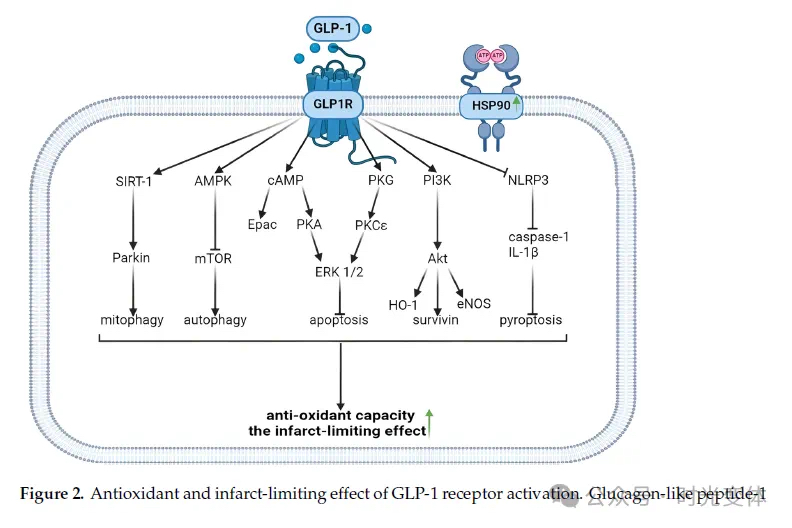
图2:GLP-1受体激活的抗氧化和梗死面积限制效应。
GLP-1受体(GLP1R)激动可通过多种信号通路减轻心肌缺血-再灌注损伤,发挥心肌保护作用。
首先,GLP1R激活可上调heat shock protein 90 (HSP90)的表达,减轻心肌细胞凋亡。HSP90是一种分子伴侣蛋白,可以稳定Akt、eNOS等心肌保护蛋白,阻止其降解。研究表明,GLP-1类似物通过诱导HSP90表达,减轻心肌梗死面积[105]。此外,HSP90还可促进SIRT1的表达和活性,而SIRT1可去乙酰化并激活多种抗氧化和抗凋亡分子,如FoxO、PGC-1等,进一步减轻心肌损伤。
其次,GLP1R激动可通过激活AMPK、PI3K/Akt、cAMP/PKA、Epac等多条信号通路,减轻心肌梗死面积。AMPK和Akt可抑制mTOR活性,减少自噬受抑,促进线粒体自噬和清除受损线粒体,改善线粒体功能。PKA和Epac则可通过磷酸化线粒体外膜蛋白VDAC,提高线粒体通透性,减轻线粒体钙超载和ROS生成。同时,PKA和Epac还可抑制NLRP3炎症小体的活化,减少IL-1等炎症介质的释放,缓解炎症反应 。
再次,GLP1R信号通路可诱导内皮型NO合酶(eNOS)和血红素加氧酶1(HO-1)等抗氧化酶的表达,并通过PKA和PI3K等激活Nrf2,上调SOD、CAT等一系列抗氧化酶,增强细胞清除ROS的能力,减轻氧化应激损伤。
此外,GLP1R激动可通过激活ERK1/2和PKC等RISK通路蛋白激酶,直接发挥心肌保护效应。PKG也是GLP-1类似物减轻梗死面积的重要媒介分子。研究发现,抑制PKG可阻断semaglutide减小梗死面积的作用,提示PKG可能通过磷酸化线粒体ATP敏感性钾通道或mPTP等下游分子,减轻线粒体介导的细胞死亡[106]。
总之,GLP1R激活可通过上述多条路径改善缺血心肌的氧化还原状态,维持线粒体功能,减轻细胞死亡,最终限制梗死面积的扩大。值得注意的是,不同研究所涉及的信号分子和作用方式可能有所差异,这可能与所用的GLP-1类似物种类和浓度、缺血时间、再灌注时间等实验条件的不同有关。但可以肯定的是,GLP-1信号通路可通过协同调控多个分子,改善心肌缺血再灌注损伤。这为进一步开发基于GLP1R的心肌保护药物提供了理论依据和药物作用靶点。
四、GLP-1信号改善心血管疾病预后的临床证据
基于以上机制,大量临床研究探索了GLP-1类似物对心血管疾病患者预后的影响。LEADER试验入组了9000多例2型糖尿病合并心血管高危患者,发现利拉鲁肽治疗组主要心血管不良事件发生率较安慰剂组降低13%,心血管死亡风险下降22%[28]。SUSTAIN-6研究发现,每周一次皮下注射索马鲁肽(semaglutide)可使糖尿病患者心血管死亡风险降低26%[29]。回顾性研究也显示,接受GLP-1类似物治疗的2型糖尿病患者全因死亡率和心血管事件发生风险均低于磺脲类等其他降糖药物[30,31]。值得注意的是,这些获益在短期内可能与降糖效果无关,而主要归因于其直接的心血管保护作用。
对于非糖尿病人群,一项入组385例急性ST段抬高型心梗(STEMI)患者的随机对照试验发现,在介入治疗前注射艾塞那肽可显著改善心肌灌注,降低梗死面积和住院后6个月的主要不良心血管事件发生率[32]。最新的荟萃分析进一步证实,在急性冠脉综合征患者中使用GLP-1类似物,可使住院和30天死亡风险降低27%,且这种获益与是否合并糖尿病无关[33]。目前正在进行的PONTIAC研究旨在纳入4000例急性冠脉综合征患者,初步结果显示利拉鲁肽可使心梗和卒中风险降低25%[34]。这些研究有望为GLP-1类似物作为心肌梗死治疗药物提供新的循证医学证据。
五、GLP-1信号通路治疗心血管疾病面临的机遇与挑战
尽管已有大量研究支持GLP-1信号通路直接参与心血管保护,但其作用机制尚未完全阐明,很多问题有待深入探究,如GLP-1类似物激活心肌保护信号的上游机制是什么?是否存在非经典的跨膜信号转导?GLP-1受体是否还有其他内源性配体?此外,GLP-1类似物能否通过促进血管新生、募集内皮祖细胞等机制促进心肌组织修复,延缓心衰进展?能否影响动脉粥样硬化斑块的稳定性和破裂风险?这些都是未来研究的重点方向。
目前GLP-1受体激动剂主要应用于2型糖尿病的血糖控制。虽然其心血管获益部分独立于降糖作用,但血糖控制不佳的患者似乎更能从GLP-1类似物治疗中获益。对于非糖尿病人群,特别是心血管危险分层较低的人群,GLP-1类似物的获益是否与其减重效果更相关?是否存在个体化差异?安全性如何?尚需大规模前瞻性随机对照试验予以验证。考虑到心血管疾病发病机制的异质性,以及GLP-1受体在心血管组织中分布的普遍性,有学者提出联合血管紧张素转化酶抑制剂(ACEI)、受体阻滞剂、他汀类调脂药等,发挥协同作用,或可进一步改善心血管疾病预后[35]。
此外,虽然小剂量GLP-1类似物已被证明可有效减轻心肌梗死面积,但对于合并低体重或恶病质的患者,减重效应可能带来心血管风险。约20-30%患者在使用GLP-1类似物后出现恶心、呕吐等胃肠道不良反应[36]。因此,严格筛选适应证,权衡利弊,对特殊人群采取个体化治疗策略至关重要。
六、小结与展望
综上所述,大量基础和临床研究为GLP-1类似物通过多种信号通路直接保护心血管提供了坚实的证据。随着研究的深入,未来有望开发出更多以GLP-1为基础的心血管保护新药,造福心血管疾病患者。当然,GLP-1类似物的减重效应对改善心血管预后也不容忽视。GLP-1信号通路与心血管病的关系将是未来研究的热点方向。
本文作者可以追加内容哦 !

