一、GLP-1制剂获美国FDA暂定批准认可 第一梯队
6月24日,翰宇药业宣布,公司及Hikma Pharmaceuticals USA, Inc.联合向FDA申报的利拉鲁肽注射液新药简略申请已获得美国FDA暂定批准*(Tentative Approval),这意味着,翰宇药业的这一重磅GLP-1靶点多肽药物在质量、安全和有效性上完全符合在美国上市的标准。作为世界医药科研水平最高、医药产业发展水平领先的美国,其对药品上市的准入标准,是世界公认最严苛的。

值得我们关注的是,这也是翰宇药业首次公开利拉鲁肽制剂产品在美国的授权合作方信息 - Hikma Pharmaceuticals,根据医药魔方研报显示,Hikma Pharmaceuticals公司曾上榜了2023年全球仿制药巨头营收排名 Top10排行榜。于1978年在约旦安曼创立,目前总部位于英国,在行业内有一个响亮的绰号-沙漠之狐,经过近40多年发展,拥有员工近万人,产品涉及760余个品种,开发的药物治疗类别包括抗感染、心血管、中枢神经系统、糖尿病、肿瘤、疼痛管理和呼吸系统疾病等等。
另外,我们也留意到,截至2024年6月24日(北京时间),美国FDA官网的利拉鲁肽获批药品目录里还是只显示了原研药诺和诺德一家,那么是否意味着翰宇药业成为第一批拿到暂定批准的玩家,实锤?!
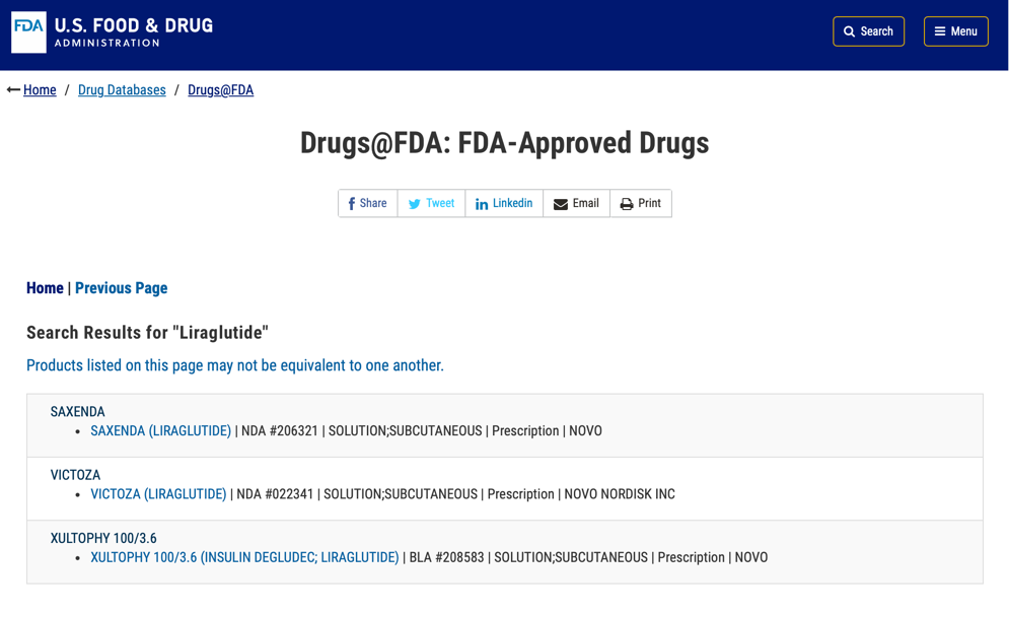
双方合作产品利拉鲁肽是一种胰高血糖素样肽-1(GLP-1)类似物,而GLP-1的火爆不仅来自于其堪称“神药”的效果,也源自于其适应症之广,涵盖减肥、降糖等多个领域。
根据灼识咨询发布的《GLP-1行业蓝皮书》显示,2022年全球GLP-1 RA市场规模约为198.5亿美元,预计凭借其显著的降糖效果,2030年将快速增长至 552.0亿美元,占全球整体糖尿病药物市场57%。美国医疗信息分析公司艾昆纬(IQVIA)最新数据显示,在多重因素的推动下,到2028年,全球肥胖药物的市场规模有望达到1,310亿美元。
在GLP-1这个蕴含巨大潜力的市场,许多中国制药企业也早已布局并且在收获果实阶段。翰宇药业作为早期布局GLP-1的玩家之一,自此也开启属于他们的“蜕变之路”。
二、破茧成蝶 国际业务高增长势态不断延续
2023年9月,翰宇药业一则公告引起行业瞩目,公司及全资子公司翰宇药业(武汉)有限公司与海外客户签署了GLP-1多肽原料药商业批的销售合同。根据合同约定,客户预计向公司及翰宇武汉合计采购累计金额3000万美元(约合人民币2.19亿元)的GLP-1多肽原料药。
也正是得益于该笔订单的不断放量,翰宇药业2023年国际业务迎来大幅增长,实现营业收入同比增长41.58%。
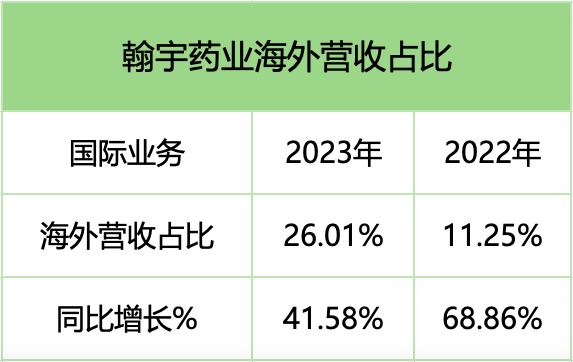
如果说利拉鲁肽原料药出口是翰宇药业破茧成蝶的开始,那一路以来FDA审评的挑战与机遇就是蜕变前必须经历的化蛹这一艰难过程。
翰宇药业利拉鲁肽注射液的海外申报是通过505(j),即ANDA(简略新药申请)路径实现的,该方式不仅针对于制剂本身需要严格把关,与制剂所关联的原料药也同样需要经过FDA审评。
2024年2月9日,翰宇药业于公众平台表示,公司利拉鲁肽原料药DMF获得No Comments or Deficiencies(即无进一步缺陷)的反馈结果,表明利拉鲁肽原料药质量获得了美国FDA的认可,满足当前关联制剂ANDA的审评要求。2023年9月至12月期间,翰宇药业多肽制剂生产基地坪山分公司、原料药生产基地武汉子公司、龙华总部研发中心均已全部取得FDA的现场检查报告(EIR),其中龙华总部研发中心更是以NAI(No Action Indicated 无需采取整改)零缺陷通过,意味着其从原料药到制剂生产线都完全符合美国动态cGMP的严苛要求。
此次利拉鲁肽注射液通过FDA的暂定批准,不仅代表其药学研究、杂质研究、质量管控等方面赢得国际顶尖审评机构FDA的认可,也意味着翰宇药业即将在国际舞台绽放他们自己的光芒。
三、BD(Business Development)交易模式开启,渐入佳境
纵观翰宇药业GLP-1进程,2.19亿元的利拉鲁肽原料药订单就像按钮一般,按下去之后,正式开启其GLP-1商业化模式,制剂及原料药订单订单纷至沓来。其中甚至包含BD(包括License授权许可交易等)这一国际化标志性交易模式。
BD模式是指“产品”(某项专利或技术,某种化合物或产品)的“引进来,走出去”,而授权引进方需向授权方支付一定的费用(首付款、里程碑付款、出货价、以及销售/利润分成等)。
翰宇药业凭借自身研发、生产和质量管控等实力,逐步获得国际市场认可。据悉,2019年翰宇药业与Hikma Pharmaceuticals签署了GLP-1药品美国的许可授权协议,后基于协议约定,分别又于2023年11月、2024年2月,收到了Hikma Pharmaceuticals的利拉鲁肽注射液制剂订单,合计金额1.75亿,且该两笔订单正是采用BD的对外许可授权(License out)合作模式,除前端里程碑交易对价外,还享有出货价、以及后端净销售额(减销售费用后)50%的利润分成。
不仅在利拉鲁肽上,翰宇药业早在2019年就前瞻性地与Hikma签署了合作协议,2023年起开花结果,迎来了制剂的大订单和陆续发货期。同时,2024年5月28日,翰宇药业官宣与电商药品销冠三生蔓迪签署合作协议 ,里程碑付款总对价金额最高约2.7亿元人民币,约定翰宇药业将与三生蔓迪共同合作开发、独家供应/采购、销售分成司美格鲁肽注射液(减重适应症),三生蔓迪将根据协议约定向翰宇药业支付里程碑付款、独家采购价、以及约两位数销售提成。
此次合作不仅体现在双方资源优势互补,可以最大化发挥协同效应产生的共鸣,更是双方就未来GLP-1市场增长预期达成一致的表现。据经济学人报道,预计2031年全球GLP-1类药物整体销售规模有望达1650亿美元规模,其中美国市场规模预计将达近1000亿美元。
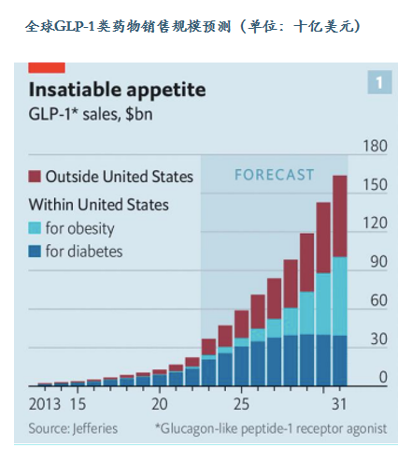
而具体到当下市场交易情况,根据此前国际减肥药巨头诺和诺德、礼来披露的2024年一季度业绩数据显示,诺和诺德实现总营收653.49亿丹麦克朗(约94.96亿美元),同比增长22%;礼来实现全球总收入87.68亿美元,同比增长26%。上述业绩增长同样证明全球糖尿病和肥胖药物市场火热且仍然具有增长潜力。
四、中国集中采购利空基本出清 华丽蜕变在即
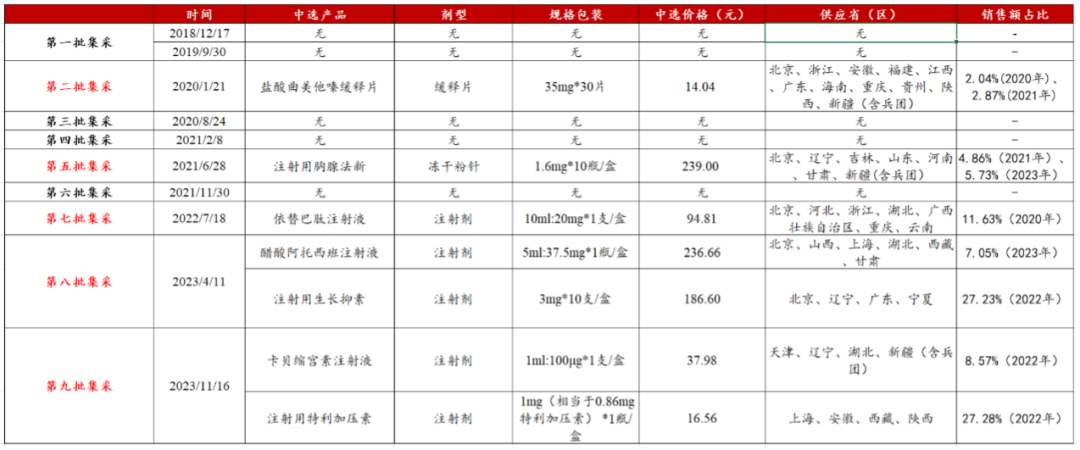
在翰宇药业海外业务增长迅猛的同时,虽然公司国内业务受集采影响承压,但统计下来,翰宇药业核心制剂产品替巴肽注射液,盐酸曲美他嗪缓释片、注射用胸腺法新、醋酸阿托西班注射液、注射用生长抑素、注射用特利加压素、卡贝缩宫素注射液均已进入集采目录,未来受集采影响基本出清,预期影响基本见底。
五、寄语
全球的医药环境瞬息万变,各位医药同仁们在面临来自市场和政策挑战的时候,是否都能沉着冷静思考,然后找准适合自己企业未来发展的道路,从而找到第二成长曲线。还记得,二战行将结束之际,英国首相丘吉尔在组建联合国期间曾说过一句话:“永远不要浪费一场好危机。”(Never waste a good crisis.)
从$翰宇药业(SZ300199)$历年业务结构变化及增长可以看出,公司通过持续不断的研发投入、BD拓展、以及不断提升国际业务占比。随着未来国际业务的不断放量、BD许可授权合作不断刷新纪录、和产品布局逐步落地,相信翰宇药业有望迎来更加广阔的增量空间。翰宇药业已经历破蛹的历炼,正在向世界迈出坚定的步伐,属于他们的“华丽蜕变”已经到来,相信未来能够在国际舞台看到更多翰宇药业的身影,将“中国制造”的FDA高质量药品带向世界!
注译*:暂定批准(Tentative Approval):指 FDA 已经完成仿制药的所有审评要求,即药品经审查,质量、安全和有效性已符合在美国上市的标准,出于专利权和/或独占权(exclusivity)原因,而给予的一种批准形式。
本文作者可以追加内容哦 !

