上市药企,财务不合规,禁入资本市场;直接送进监狱;生产不合规,“处罚到人”,生产、质量负责人禁入医药产业,职业生涯或变相被判“死刑”
撰文|Erin 润屿
编辑|顿河
一把从研发,生产,到流通、销售,针对药品全生命周期各阶段的出清“利刃”,出击更快、刺得更狠、把得更严了。
在“暗疮”频发的生产环节,今日陕西省药监局直接公布典型案例,落实药品违法行为“处罚到人”的规定。而在近期,药企生产、质量负责人,愈发成为了一门高危职业,少则禁业5年、10年,多则长达25年、30年,有的也许等处罚一过都能退休了,职业生涯变相被判“死刑”。让人出冷汗的是,现在更有药企因违法GMP,核心班子几乎“全军覆没”。
就在近期,河北省药品监督管理局公布了一家名为弘汉药业的中药饮片企业,因未遵守《药品生产质量管理规范》,被罚177万元的同时,还被吊销药品生产许可证,企业法定代表人、企业负责人、质量负责人和生产负责人更是集体被禁业30年。
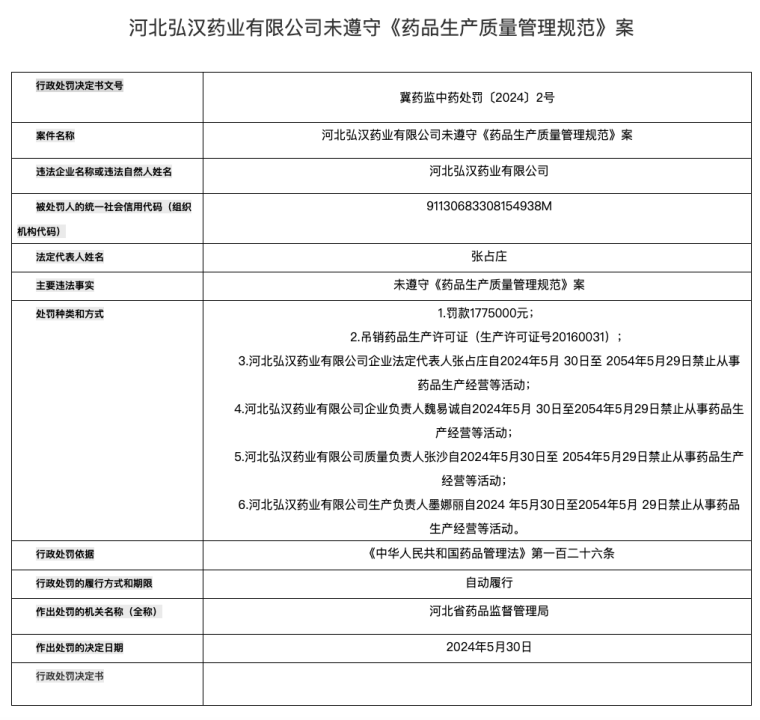
来源:河北省药品监督管理局
一扫过去,直接罚了个片甲不留,违反GMP导致禁业具体原因尚且不明,但就这惩处力度,可以肯定的是情节极其严重,踩了《药品管理法》红线的同时,有行业人士推测,编造药品生产检验记录肯定有,大概率还包括生产“假药”。
众所周知,新《药品管理法》正式实施以来,生产端把关愈发严格,财产处罚和资格处罚力度大幅提高,尤其对假劣药违法行为责任人的资格处罚由十年禁业提高到了终身禁业,一双“法眼”严盯MAH药品质量监督管理的5大关键岗位。去年3月,国家药监局从监管层面又再次明确了MAH落实药品质量主体责任监督管理的要求,自此多家药企的生产、质量负责人登陆数份黑名单,处罚力度加剧。
MAH作为药品注册证书的所有人,需要对药品整个生命周期全面承担责任,必须具备保障药品的安全性、有效性和质量可控性的质量管理、风险防控体系和责任赔偿三大方面的能力。
如果质量负责人管不好自己的手,老板管不好业务部的手,监管部门那也就无法“放手”。最终,遭殃的不仅是企业,持有人几大关键岗位人员还可能断送自己的职业生涯。
1年两度严重违反GMP,“禁业30年”只是个开始?
“世界就是个巨大的草台班子”——弘汉药业就在演绎这句话。
天眼查信息显示,弘汉药业成立于2014年,主要从事中药饮片加工,参保人数为3,有意思的是,此次被禁业的人数却为4,这么看来,这家公司的关键人员有的可能是挂职。
这是一家“劣迹”斑斑的公司。从2018年开始,弘汉药业几乎连年上榜黑名单:
2018年,因生产劣药炒紫苏子被罚没一定金额;2019年,因涉嫌生产假劣药品被立案调查;2020年,因生产(包括配制)、销售、使用经检验不符合药品标准、炮制规范的药品、中药饮片、医疗机构制剂,被安国市市场监督管理局又被罚没一定金额;2022年,国家药监局发布关于17批次药品不符合规定的通告,这家公司生产的中药饮片紫草也被通报,不符合规定项目为性状。
最值得关注的是2023年和2024年发生的两起违反GMP事件。
2023年4月,据河北省药监局披露,因违反药品生产质量管理规范情节严重,弘汉药业被罚款72.5万元;责令停产停业;同时企业负责人刘小维处罚没上万元金额,并处10年内禁止从事药品生产经营等活动。
而近期,弘汉药业又被河北省药监局通报,企业法定代表人张占庄、企业负责人魏易诚、质量负责人(同时也是质量受权人)张沙、生产负责人墨娜丽集体被禁业30年。加上2024年这次处罚,弘汉药业两次罚款合计约250万元。

(来源:天眼查)
前后两次处罚依据,均为《中华人民共和国药品管理法》第一百二十六条,所含关键信息为:药品上市许可持有人等未遵守药品生产质量管理规范等,情节严重的,处五十万元以上二百万元以下罚款,责令停产停业整顿直至吊销药品批准证明文件、药品生产许可证等,对法定代表人、主要负责人、直接负责的主管人员和其他责任人员,没收违法行为发生期间自本单位所获收入,并处所获收入百分之十以上百分之五十以下的罚款,十年直至终身禁止从事药品生产经营等活动。
自2023年3月1日施行《药品上市许可持有人落实药品质量安全主体责任监督管理规定》以来,最终责任人落实到具体人头上的处罚,频率更高,处罚更严、更狠了。2020年、2021年时被罚5年、10年禁业,被罚几十万居多,但自2023年起,没收违法收入、责令停产只是起步,负责人被处20年往上禁业的几乎成了常态。
2023年7月,河南龙亭药业涉嫌未遵守药品生产质量管理规范生产复方硫黄乳膏,罚款百万,责令停产停业3个月,企业负责人禁业25年。
2023年12月,安徽济善堂中药科技有限公司因累计出现抽查不合格报告书31份、累计行政处罚11次、连续3次被列为高风险企业,同时存在出租生产许可证等行为,被依法吊销生产许可证、处罚百万元,企业原负责人被处10年禁业。
同月,陕西宝鸡金森制药有限公司未按《药品生产质量管理规范》组织生产,被处200万元罚款,责令停产停业整顿2个月,公司实际控制人被处10年禁业。
2024年2月,江西药监局发布了两则行政处罚通知:江西众泰堂中药饮片有限公司因违反GMP情节严重被处罚,其企业负责人违反GMP情节严重被处以罚款、没收违法所得和10年禁业处罚。
MAH制度与药企的担子
事实上,上述企业负责人、生产负责人、 质量负责人等职务人员被高额罚款、禁止从业的背后,是MAH制度实施中各项规定的严格执行。MAH制度的底层逻辑是上市许可持有人对药品的全生命周期负责,这是监管理念的一次重大改变。
自2019年以来,MAH制度在全国范围内推广,从落实主体责任,再到细则逐步完善,目前已经构成了集药品上市许可持有人资质、责任范畴、关键岗位人员配备、人员资质等全方位的规范。
在2020年国家市场监管总局公布的《药品生产监督管理办法》(以下简称“《办法》”)全面落实MAH制度的规定中就明确,“药品上市许可持有人应当建立药品质量保证体系,履行药品上市放行责任,对其取得药品注册证书的药品质量负责。”
这其实是将保证药品生产质量的责任落实到“药品上市许可持有人”,由其对安全性、有效性、质量可控性、风险防控以及责任赔偿等药品的全生命周期负责。
并且,还对“药品上市许可持有人”的质量监管体系进行了详细规定,将责任落实到具体职务负责人的头上。例如,设置企业负责人、生产负责人、质量负责人、质量受权人、药物警戒负责人五大全职岗位;药品上市许可持有人的法定代表人、主要负责人应当对药品质量全面负责;专门质量负责人独立负责药品质量管理;专门质量受权人独立履行药品上市放行责任;监督质量管理体系正常运行。
同时,《办法》中还明确,省级药品监督管理部门应每年抽取一定比例开展监督检查,但应当在三年内对本行政区域内企业全部进行检查。
在此过程中,诸多问题也暴露出来,比如持有A证、B证的企业未建立有效的质量管理体系,相关负责人并未各自独立,B证企业当“甩手掌柜”,甚至是相关负责人并未落实到岗等问题层层暴露。有地方药监局相关负责人曾告诉E药经理人,“曾出现质量负责人和质量受权人,在生产前引进关键人员,许可证批了,企业养不起就放弃了。” 这也为如今监管部门对B证类药企审批收紧埋下伏笔。
2021年7月,广东省药品监督管理局审评认证中心对该省30家B证申报方现场检查发现的260条缺陷进行了分析,其中,质量管理体系建设存在缺陷条数就占比63%,机构与人员存在缺陷条数占比25%。
面对MAH执行中的问题,2023年药监部门发布了《药品上市许可持有人落实药品质量主体责任监督管理规定》和《国家药监局关于加强药品上市许可持有人委托生产监督管理工作的公告》(以下简称“132号文”),前者详细规定了生产环节五大岗位职责、资质;后者是被业界称为史上最严、最细的委托生产文件。
从时间段来看,按照《办法》中的要求,三年生产合规大考接近收关,虽在此过程中,针对B证收紧乃至停发的讨论持续发酵,但行业仍然期待在严格的监管与狠厉的处罚震慑到落后产能出清,生产不合规消除,伴随着药企的全生命周期质量管理体系日渐完善时,MAH制度鼓励创新、优化分工、充分利用剩余产能的政策效果能够真正体现出来。
本文作者可以追加内容哦 !

