普利制药泊沙康唑注射液通过国内一致性评价批准上市!

海南普利制药有限公司(以下简称“普利制药”或“公司”)于近日收到了国家药品监督管理局(以下简称“NMPA”)签发的泊沙康唑注射液的药品注册批件,视为通过一致性评价批准上市,将为拓展国内市场带来积极影响。
泊沙康唑注射液的上市,将进一步完善和丰富公司抗感染产品管线,更好地满足临床用药需求,为广大患者提供更多更优的用药选择。同时,作为公司中美双报的产品,泊沙康唑注射液在美国上市审评中。
新一代三唑类抗真菌药物,市场前景广阔
泊沙康唑作为新一代三唑类抗真菌药物,与其他三唑类抗真菌药物作用机制相似,主要通过抑制CYP450依赖的14-脱甲基酶进而抑制麦角甾醇的合成,导致真菌细胞膜的生物合成障碍,细胞膜通透性改变,从而抑制真菌生长。其抗菌谱既包含常见的念珠菌、隐球菌和曲霉,也包含毛霉、球孢子菌、镰刀菌、多育赛多孢子菌等罕见真菌。与棘白菌素和其他三唑类药物相比,泊沙康唑抗菌谱更广,抗菌活性较强,耐受性好,在侵袭性真菌病(IFD)的预防和治疗领域适用范围广泛,是众多权威指南、共识中一线推荐的抗真菌预防和治疗药物。
泊沙康唑由默沙东公司研发,于2005年10月25日首次获得欧洲药物管理局批准上市,之后于2006年9月15日获得美国食品药品管理局(FDA)批准上市,其注射剂于2014年3月13日获得FDA批准。2021年1月30日,由Merck Sharp & Dohme B.V.持有的泊沙康唑注射液在中国获批,当前中国境内泊沙康唑已上市的剂型包括口服混悬液、肠溶片及注射液,三种剂型均可用于预防IA和念珠菌感染,肠溶片及注射液被批准用于治疗IA。
抗真菌药品种在国内拥有良好的市场空间,市场需求尚未达到饱和,并且随着抗真菌药的耐药性不断增加,临床仍亟需新型、迭代的抗真菌药来填补空白治疗需求。泊沙康唑注射剂型自2021年在中国获得上市批准以来,迅速在市场上占据一席之地。2022年,泊沙康唑注射液成功通过了国家医保谈判,被纳入2022版国家医保谈判目录(医保乙类),并于2023年3月1日正式执行。
尽管上市时间尚短,截至2023年,泊沙康唑注射剂在公立医院的销售额已达9115万元。与其他成熟的抗真菌药物相比,泊沙康唑注射剂的销售额虽然尚未达到同等水平,但其近3年销售额的复合增长率高达181.15%,这一数字远超同类产品,显示出其在市场上的强劲增长势头和巨大的发展潜力。
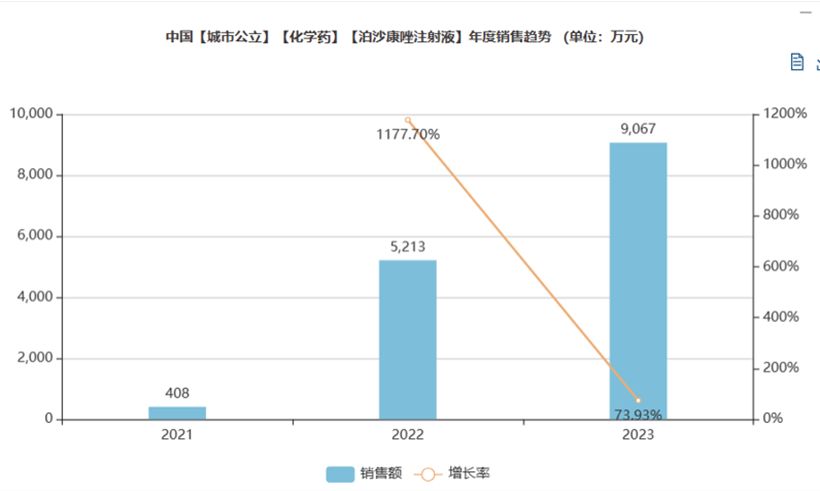
图1:米内网【泊沙康唑注射剂】近3年销售额
另一方面,根据2024年5月27日国家药品监督管理局发布的公告(2024年第66号):为更好满足儿童临床用药需求,经研究论证,有7个药品的说明书可以按要求增加儿童使用人群及用法用量。其中,泊沙康唑注射液在列,基于这一新的适应症扩展,泊沙康唑注射液的适用人群和用法用量将进一步扩增至儿童患者群体,将更有效地满足临床上对儿童患者的用药需求,为儿童健康提供更为精准和安全的治疗方案,同时对于泊沙康唑注射液的商业价值也将进一步扩大。
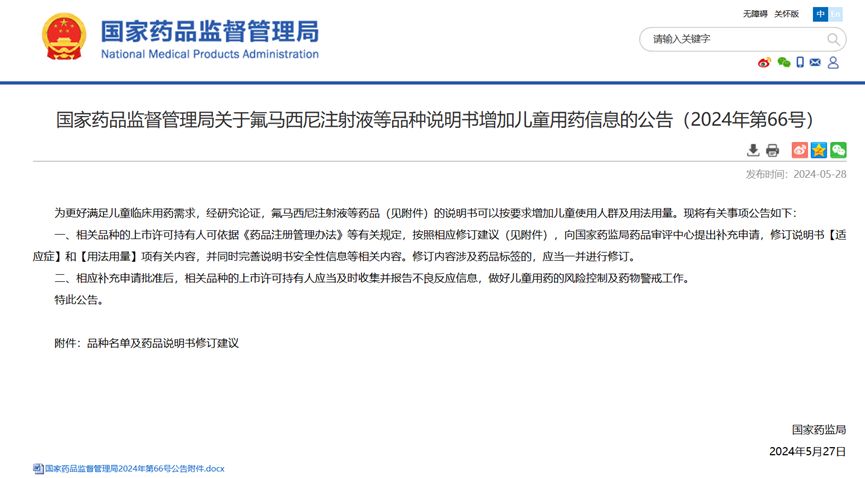

图2:国家药品监督管理局发布的公告(2024年第66号)和附件所列泊沙康唑注射液儿童适应症和用法用量的修订内容
普利制药
海南普利制药股份有限公司1992年成立于海口,是中国医药制剂国际化先导企业和国家工信部智能制造示范企业,已被国家工信部纳入工业转型升级中国制造2025年儿童药重点项目企业。2017年在创业板上市后,短短3年已成为中国上市公司科技创新百强企业。公司从事药品国际化开拓以来,至今已获得了155个国际制剂上市许可,产品远销世界各地。
未来,普利制药将一如既往地实施“先进高端制造, 面向国内国际”的全球战略,持续不断研发更多更好的药物;走向世界,为民族医药工业的强大持续作出贡献,让中国老百姓用上出口欧美的国际化高品质药品。

本文作者可以追加内容哦 !

