欢迎关注凯莱英药闻

7月10日,百利天恒向港交所主板提交上市申请,高盛、摩根大通、中信证券为其联席保荐人。
一、公司简介
百利天恒是一家集药品研发、生产与营销一体化的现代生物医药企业,具备包括小分子化学药、大分子生物药及抗体偶联药物(ADC 药物)的全系列药物研究开发生产能力;拥有中美两地研发中心(美国:Systimmune;中国:百利药业和多特生物等)、1 个大分子生物药及抗体偶联药物(ADC药物)生产企业(多特生物)、2 个化药制剂生产企业(百利药业和国瑞药业)、1 个化学原料药生产企业(精西药业)、1 个化学中间体生产企业(海亚特科技)以及 2 个药品营销公司(百利天恒和拉萨新博);覆盖从中间体、原料药到制剂的上下游一体化能力及“研发—生产—营销”完整全生命周期商业化运营能力。
二、研发平台
自 2011 年开始,公司聚焦于双/多特异性抗体及 ADC 药物的创新研发。经过 10 多年的自主 研发与技术积累,公司已形成了创新药相关的拥有自主知识产权的“多特异性抗体新型分子结构平台”、“全链条一体化多特异性抗体药物研发核心技术平台”、“全链条一体化 ADC 药物研发核心技术平台”、“柔性GMP 标准多特异性抗体及 ADC 药物生产技术平台”四大创新抗体 /ADC 相关的核心技术平台。公司已构建创新性多特异性抗体及 ADC 药物相关的完备核心技术体系,可独立自主完成创新药物全程研发与早期商业化生产。
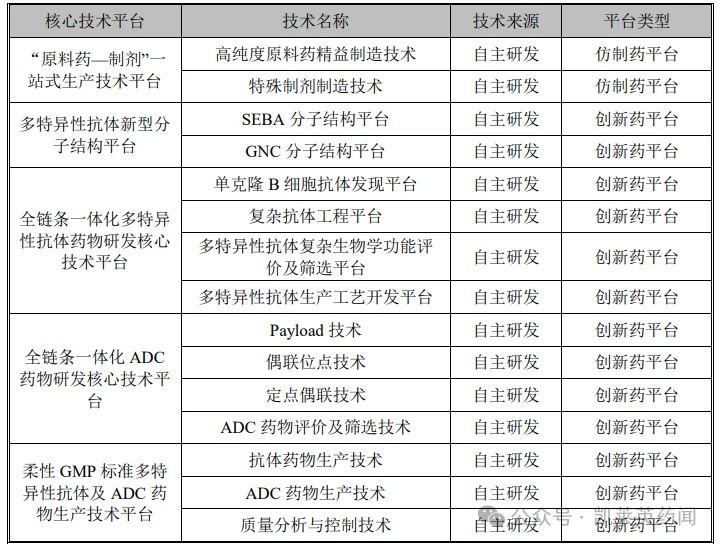
具体情况如下:
(一)“原料药—制剂”一站式平台
主要涉及高纯度原料药的精益制造技术和制剂的制备工艺技术,该平台的核心技术,集中体现在高纯度原料药精益制造和特殊制剂的制造上;通过对上游的原料药,到下游的制剂全环节进行一体化把控,公司可以在原料和制剂的制备过程中对关键步骤、关键参数、处方种类与用量、生产工艺等方面进行优化设计,达到相比现有技术安全性更好、环境更友好、质量稳定性更优的技术效果,同时实现研发和生产成本的有效降低。
(二)多特异性抗体新型分子结构平台
1、SEBA 分子结构平台:是公司独立开发的、具有完全自主知识产权的双特异性抗体开发平台。该平台下开发得到的抗体分子,可同时结合靶细胞上的两个不同靶点。通过选择不同的靶点组合、调节抗体分子对于靶点的亲合力,可实现抗体分子增强、拮抗、选择性等不同的生物学效应,从而获得增强的特异性。相较于常规抗体分子具有可作用于双靶点,实现更丰富的药理活性;制备难度更大,技术壁垒更高,对于靶点特异性更强。
2、GNC 分子结构平台:用于开发具有对称/不对称结构的、可同时靶向四种不同抗原的多特异性抗体。基于该平台所研制出的四特异性GNC 抗体分子,可以通过多个肿瘤/免疫相关蛋白结构域(功能模块)间的协调作用,全面、系统、深度的激活肿瘤患者的免疫系统,完成对肿瘤细胞的“制导”、“导航”和“控制”过程,最终实现针对肿瘤的靶向性、激发型免疫攻击。
3、全链条一体化多特异性抗体药物研发核心技术平台:可独立自主的完成从抗体发现到抗体生产工艺开发的全环节,包括单克隆 B 细胞抗体发现平台、 复杂抗体工程平台、多特异性抗体复杂生物学功能评价及筛选平台、多特异性抗体生产工艺开发平台。
4、全链条一体化 ADC 药物研发核心技术平台:涉及到高特异性抗体的研发、Payload 的研发(包括小分子毒素、释放单元、接头的研发)、定点偶联位点的研发、定点偶联技术的研发、完整 ADC 药物分子评价和筛选的研发。
5、柔性GMP标准多特异性抗体及ADC药物生产技术平台:由抗体药物生产、ADC 药物生产、质量分析与控制三大部分组成。平台包括细胞培养、蛋白纯化、抗体制剂灌装、Payload 生产、ADC 偶联、ADC制剂灌装/冻干和质量控制等核心生产技术单元。
三、财务情况
公司分别于2021年、2022年、2023年分别实现营业收入约7.95亿、7.02亿、5.6亿人民币,年内溢利分别约为-1.08亿、-2.82亿、-7.8亿人民币。值得注意的是,公司研发投入占营业收入的比例在逐年增加,2021年-2023年分别为34.97%、53.32%、132.81%。
截止2024年第一季度,期末现金及现金等价物余额为58.12亿元。
三、产品管线及部分创新药介绍
公司拥有两大业务板块,分别为创新生物药业务和化药制剂、中成药制剂业务板块;专注于麻醉、肠外营养、抗感染、儿科等临床亟需治疗领域,同时在乳状注射剂、泡腾制剂等特殊制剂方面,积累了丰富的研发、生产和营销经验,形成了富有特色和优势的产品集群。
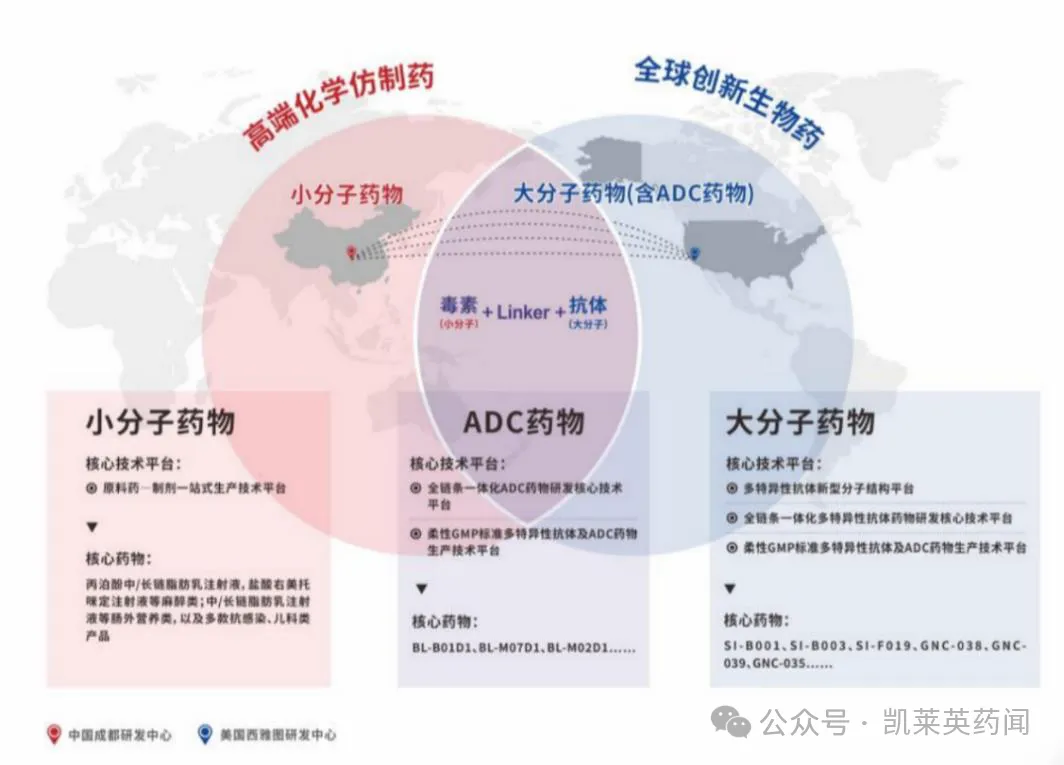
目前,主要销售的产品有:麻醉类包括静脉麻醉镇静药物“丙泊酚乳状注射液”、“丙泊酚中/长链脂肪乳注射液”,新一代的拟睡眠镇静药物“盐酸右美托咪定注射液”。肠外营养类包括“中/长链脂肪乳注射液”等,抗感染类以利巴韦林颗粒和奥硝唑胶囊为代表,儿科类药品主要 包括葡萄糖电解质泡腾片、消旋卡多曲颗粒,中成药制剂主要包括黄芪颗粒和柴黄颗粒等。
据不完全统计,公司创新生物药研发管线的整体进展情况如下图所示:
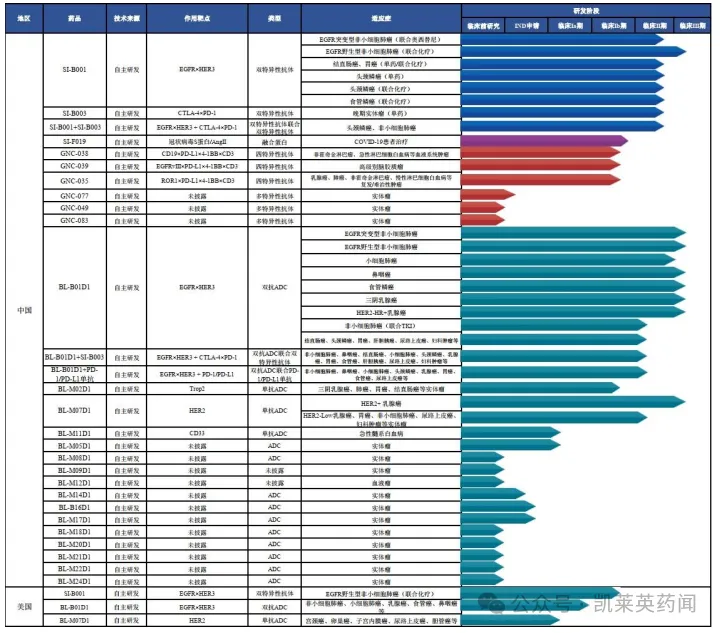
截止2024年4月,公司共启动9项III期临床试验,其中双抗ADC药物BL-B01D1共开展6项,靶向HER2 ADC药物BL-M07D1共开展1项,靶向EGFR/HER3 双抗开展2项。
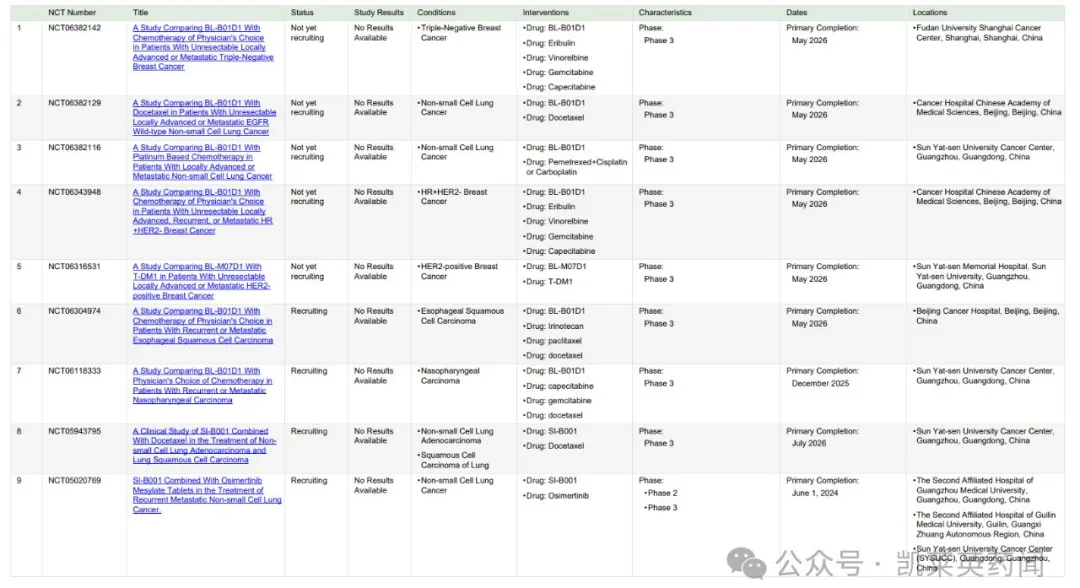
1、靶向EGFR/HER3 双抗ADC:BL-B01D1
BL-B01D1是全球首创的EGFR/HER3双抗ADC 药物,其双抗部分是SI-B001,通过使用抗EGFR Fab 和抗HER3scFv 构建而成,随后与喜树碱衍生物Ed-04 小分子毒素结合,增强了针对性和安全性。BL-B01D1 通过双目标交联促进协同内化,通过结合SI-B001 和小分子毒素实现对EGFR依赖肿瘤的定向杀伤,同时也减轻了由HER3 引起的药物耐药性。同时,BL-B01D1 具有高达8 的DAR 值,在临床前研究中表现出的肿瘤杀伤效应明显优于EGFR 单抗和HER3 单抗。
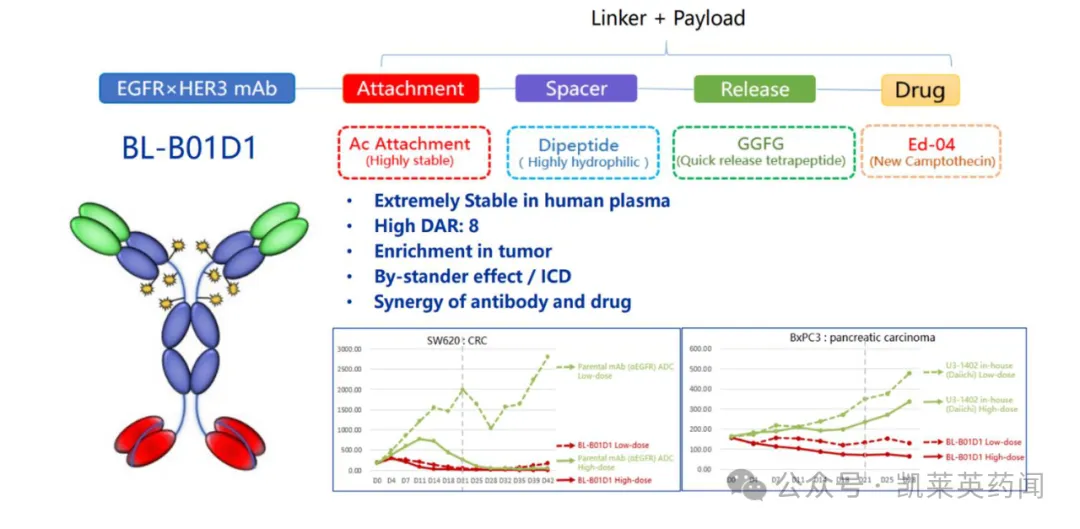
2023 年12 月,百利天恒全资子公司SystImmune与百时美施贵宝(BMS)就BL-B01D1 项目达成独家许可与合作协议,双方将合作推动BL-B01D1 在美国的开发和商业化。SystImmune 将独家负责中国大陆地区的开发和商业化,而BMS 将独家负责BL-B01D1 在全球除美国、中国大陆以外其他地区的开发和商业化。这一协议已于24 年2 月8 日生效,公司于24 年3 月收到了BMS 支付的全部共8 亿美元的首付款项。而根据协议,在达成开发、注册和销售里程碑后,SystImmune 将获得最高可达71 亿美元的额外付款,潜在总交易额最高可达84 亿美元。
截至2024 年4 月,公司针对B01D1 已经启动作为单药治疗非小细胞肺癌、鼻咽癌、食管癌、结直肠癌、乳腺癌、小细胞肺癌、尿路上皮癌及胃癌等多种局部晚期或转移性实体瘤,以及与SI-B003 联合使用治疗多种实体瘤共计13 项临床试验,其中针对鼻咽癌、食管鳞癌及乳腺癌的3 项国内临床已推进至3 期阶段。
2023 年12 月,公司在SABCS 会议上披01D1 在HER2不同表达程度的乳腺癌患者中的积极数据,其中TNBC 的ORR 为31.4%,DCR 为91.4%,HR+/HER2 低/无表达乳腺癌的ORR为44.70%,HER2+高表达乳腺癌ORR 为39.1%。
2023年9月,公司在ESMO 大会上公司公布的B01D1 治疗NSCLC 患者的疗效数据:截止2023 年8 月17 日,整体入组患者ORR 达到51%,DCR 87.3%,mPFS 5.6 月。其中,EGFR 突变患者共40 例,经受治疗中位线数为3,基线CNS 转移55%,实现ORR 67.5%,mPFS 5.6 月;13 例患者不伴脑转移或脑转移经治,实现ORR 69.2%,mPFS 15 月;EGFR 野生型患者共62例,经受中位治疗线数为3,基线CNS转移16%,实现ORR 40.3%,mPFS 5.4 月。在安全性上,369 例经受Q3W 治疗方案的患者中,≥3 级TRAE发生率为61%,排名前3的副作用分别为中性粒细胞减少36%,白细胞减少32%,血小板减少28%。靶向毒性如EGFR 的主要副作用皮疹和腹泻相对较低,≥3 级TRAE 发生率仅为1%。
2023年6月,公司在ASCO 会议披露了B01D1 在鼻咽癌(NPC)中的积极数据:在24 例NPC 患者中,既往中位治疗线数为3,实现ORR 45.8%,DCR 100%。
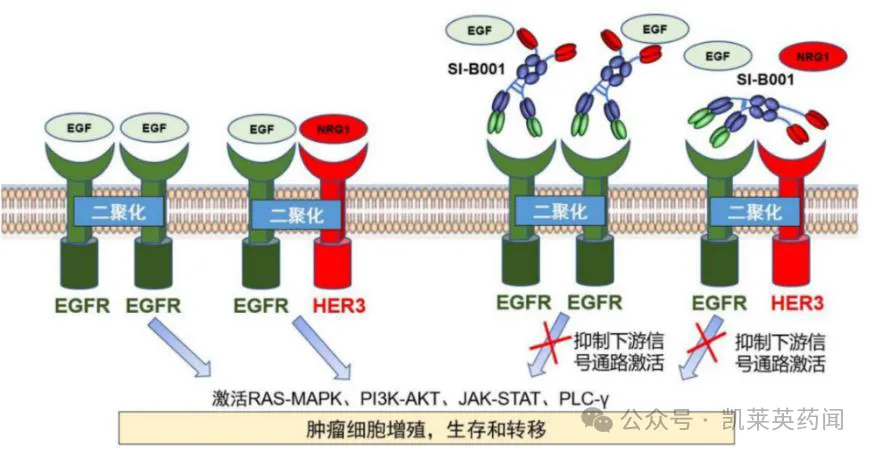
2、靶向EGFR/HER3 双抗:SI-B001
SI-B001(Izalontamab)是具有FIC 潜力的EGFR/HER3 双抗,能够阻断肿瘤细胞表面的EGFR 与其配体EGF、HER3 与其配体NRG1 的结合,抑制由此引发的EGFR同源二聚体及EGFR 与HER3 异源二聚体的形成,从而进一步抑制了EGFR 和HER3 相关的信号传导通路,达到抑制肿瘤细胞的增殖、存活和转移,进而杀灭肿瘤细胞的目的。目前,该药物已在非小细胞肺癌、结直肠癌、食管鳞癌、头颈鳞癌等多个上皮肿瘤上开展6 个2 期临床研究。
在非小细胞肺癌适应症中,该药物联合联合奥西替尼治疗野生型NSCLC 的II 期临床试验显示,ORR 25.00%,DCR 91.67%;联合多西他赛治疗经历了含PD-(L)1单抗治疗失败的NSCLC 患者,ORR 32.50%,DCR 80.00%。
在头颈鳞癌适应症中,其中联合化疗治疗经历过PD-(L)1 单抗+含铂化疗的复发转移性头颈鳞癌患者的II 期研究中,13 例可评估的患者ORR 为61.54%,DCR 为92.31%。
在复发转移性食管鳞癌的适应症中,二线及后线治疗高剂量组的11 例患者中的ORR 达到45.45%,DCR 达到90.91%。
I 期临床显示,该药物在54 例可评估的末线晚期实体瘤患者中的ORR 为 5.56%,DCR 为42.59%;发生皮肤毒性概率总体低于西妥昔单抗和 U3-1402;发生胃肠道毒性的概率总体低于西妥昔单抗、U3-1402 和 Duligotuzumab,未发生药物相关的患者死亡事件,整体安全性良好。
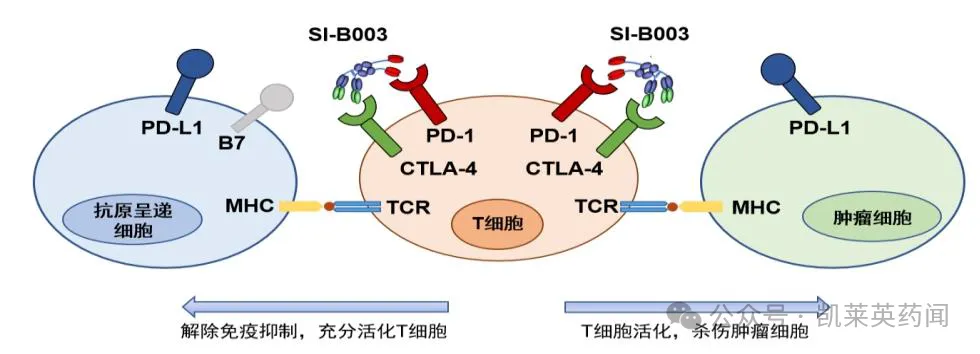
3、靶向PD-1 /CTLA-4双抗:SI-B003
SI-B003(Danvilostomig)可以同时靶向并阻断PD-1 与CTLA-4 靶点,通过抑制PD-1和CTLA-4 与其配体的结合,同时还能增强SEB 超抗原诱导的免疫应答,有效恢复T 细胞的免疫效应功能,从而增强其抗肿瘤活性。
目前,公司已开展SIB003单药治疗多种实体瘤后线患者的I 期临床试验、以及联合SI-B001 治疗头颈鳞癌一线患者的Ib/II 期临床试验;此外,与BL-B01D1/化疗联合治疗多种一线实体瘤患者方案的临床试验已批准,并计划推进SI-B003 与其他药物组合的关键注册临床研究。
I 期临床初步分析数据显示,可评估的46例实体瘤患者ORR 为19.56%,DCR 为56.52%,其中20 例经历含PD-1(L1)单抗治疗后耐药的患者实体瘤患者ORR 为25%,DCR 为65%。在安全性上,不良反应大多较轻微,未出现药物相关的死亡。
4、靶向HER2 ADC:BL-M07D1
BL-M07D1是一款自主研发靶向HER2 的ADC采用的是拓扑异构酶抑制剂类小分子毒素 Ed-04 以及 Ac 接头,药物具有更佳的亲水性,同时不易聚集,在体内具有更高的安全性和抗肿瘤活性。临床前研究表明,在NSCLC 细胞NCI-H1975 小鼠模型中,用药28 天后M07D1 使得肿瘤细胞缩小的体积远大于DS-8201,证明了BL-M07D1 在肿瘤模型中的表现优于第一三共的DS-8201。
3 线治疗乳腺癌患者中的数据显示:ORR 达到了78.9%。观察到的主要副作用集中于血液毒性,没有发现间质性肺病(LD)的病例。
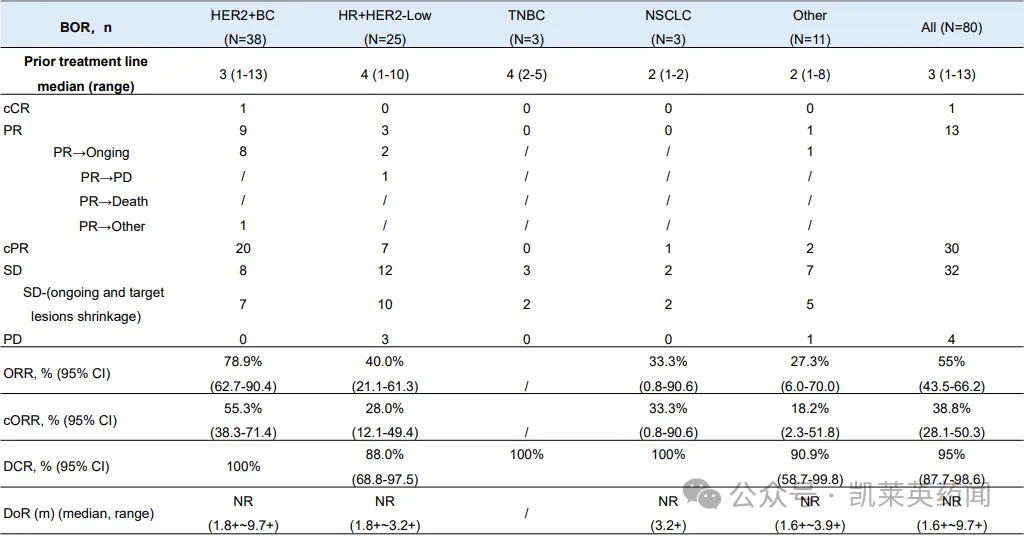
5、靶向Trop2 ADC:BL-M02D1
BL-M02D1与Trop2高表达的肿瘤细胞特异性结合,并经由内吞作用被细胞摄入;同时,借助水解酶的催化释放其携带的小分子毒素,完成对肿瘤细胞的DNA 复制及RNA 合成过程的干扰,致使肿瘤细胞凋亡。目前,该药物处于I 期研究剂量爬坡阶段。
临床前研究显示,在人细胞BxPC3 小鼠模型中,用药28 天后,BL-M02D1使得肿瘤细胞缩小的体积显著超过DS-1062;说明BL-M02D1在肿瘤模型抑制试验结果优于第一三共的同靶点ADC药物DS-1062。
6、靶向4-1BB/CD3/PDL1/CD19多抗:GNC-038
GNC-038(Emfizatamab)是一款靶向4-1BB/CD3/PDL1/CD19的四抗,是全球第一个进入临床研究阶段的四特异性抗体药物, 已在用于治疗非霍奇金淋巴瘤和急性血液淋巴瘤的 I 期临床试验中展现出了良好的疗效和耐受性。
7、靶向4-1BB/CD3/PDL1/EGFRvIII多抗:GNC-039
GNC-039是一款靶向4-1BB/CD3/PDL1/EGFRvIII的四抗,拟用于复发/难治性脑胶质瘤或其他实体瘤的治疗。
参考资料
1、公司官网
2、福布斯中国、中国证券报
3、东吴证券、财通证券
本文作者可以追加内容哦 !

