7月10日,诺和诺德今天宣布,已收到FDA发出的关于每周一次的基础胰岛素 icodec 用于治疗糖尿病BLA的完整回复函(CRL)。
FDA提出了关于生产工艺和1型糖尿病适应症的要求。诺和诺德表示将与FDA密切合作以满足这些要求,但时间上预计无法在今年满足。

依柯胰岛素(insulin icodec)是诺和诺德在口服胰岛素OI338基础上设计的一款超长效胰岛素制剂。其独特之处在于,注射后Icodec即可与白蛋白牢固、可逆结合,形成“循环存储库”,在人体内半衰期可长达196小时(约7天),从而满足患者一整周的基础胰岛素需求。由于采取了浓缩配方,Icodec一次注射剂量相当于一周内每天注射甘精胰岛素U100,大幅简化治疗流程。
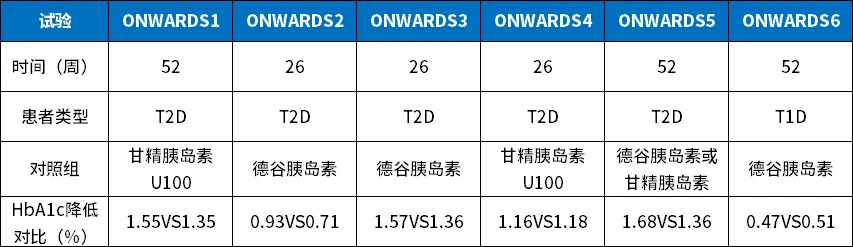
2023年4月,诺和诺德同时向中国大陆、欧盟和美国递交了每周注射一次的胰岛素icodec,用于1型和2型糖尿病患者治疗的注册申请。该申请基于 ONWARDS 临床试验计划,涉及六项全球 3a 期试验。
依柯胰岛素ONWARDS(1-6)临床数据
美国:2024年5月获悉,诺和诺德每周一次的胰岛素icodec未获大多数FDA顾问认可。
FDA 咨询委员会表示,诺和诺德每周注射一次的胰岛素icodec的益处并未胜过风险。5月FDA科学家提供的一份简报文件显示,“在一项关键试验中,与诺和诺德每日注射一次的德谷胰岛素注射剂(商品名Tresiba)相比,依柯胰岛素注射液可能会导致患者出现低血糖问题。” FDA咨询委员会没有讨论在2型糖尿病中使用每周一次的胰岛素icodec。
欧洲:2024年5月24日,Icodec获批上市,用于治疗成人糖尿病。
中国:2024年6月24日,获批用于治疗2型糖尿病。第十版IDF糖尿病地图显示,中国成人糖尿病患者总数高达1.4亿,居世界各国之首。其中,2型糖尿病患者占大多数。

此外,胰岛素icodec在加拿大、澳大利亚、日本和瑞士以Awiqli品牌被批准用于治疗1型和2型糖尿病。
小结
当前超长效胰岛素的研发进展方面,礼来的重组基础胰岛素,融合Fc结构域的重组基础胰岛素(Weekly Basal Insulin Fc, BIF)也在不断推进,该款胰岛素周制剂LY-3209590适用于1型糖尿病和2型糖尿病,目前进行到临床3期阶段。
国内胰岛素企业也在布局长效胰岛素。国产药物中进展最快的胰岛素周制剂当属甘李药业的GZR4,目前处于临床2期阶段,适应症为糖尿病。今年6月甘李药业在2024 ADA公布,与依柯胰岛素注射液相比,GZR4与人血清白蛋白亲和力显著增加,胰岛素受体亲和力明显降低。GZR4在和白蛋白结合形成复合体后,依然能够保持激活胰岛素受体的活性。在糖尿病动物模型的研究中,GZR4的降糖效果是依柯胰岛素注射液的2~3倍。
本文作者可以追加内容哦 !

