研究介绍
•
研究背景
Background
肝癌是全球癌症相关死亡的主要原因之一,其早期诊断和治疗至关重要。肝癌的发病机制复杂,涉及多种因素,包括病毒感染、酒精、脂肪肝等。肝癌的早期症状不明显,往往在晚期才被发现,此时治疗难度大,预后差。
荧光手术导航作为一种新兴技术,能够帮助医生更精确地切除肿瘤,并最大程度地保留健康组织,减少术后并发症。
肿瘤细胞代谢旺盛,产生大量酸性物质,导致溶酶体酸化。因此,肿瘤细胞内溶酶体pH值显著低于正常细胞。pH值可以作为肝癌微环境的酸碱度标志,用于区分肿瘤细胞和正常细胞。
组织蛋白酶是一类重要的溶酶体蛋白酶,在肿瘤侵袭和转移过程中发挥着重要作用。组织蛋白酶能够降解细胞外基质,促进肿瘤细胞浸润和转移。此外,组织蛋白酶还能够激活其他蛋白酶,进一步促进肿瘤的进展。
荧光探针是荧光手术导航的关键,直接影响手术的结果。传统的单锁荧光探针(例如仅响应pH值或组织蛋白酶)在复杂的生物环境中容易受到干扰,导致信号/背景比(SBR)低,影响成像的准确性。为了克服这一局限性,本研究设计了双锁荧光探针SiR-CTS-pH,使其同时响应pH值和组织蛋白酶。
传统探针设计主要依赖于化学家和生物学家的经验,难以保证设计的准确性,且研发周期长,需要进行大量的实验,需要消耗大量的试剂和材料,成本高。机器学习算法能够从大量的数据中学习规律,并预测未知分子的性质,从而指导分子设计和合成。
因此,本研究利用机器学习辅助设计了一例新型双锁荧光探针SiR-CTS-pH,以提高荧光导航手术切除肝癌的准确性和SBR。(图1)
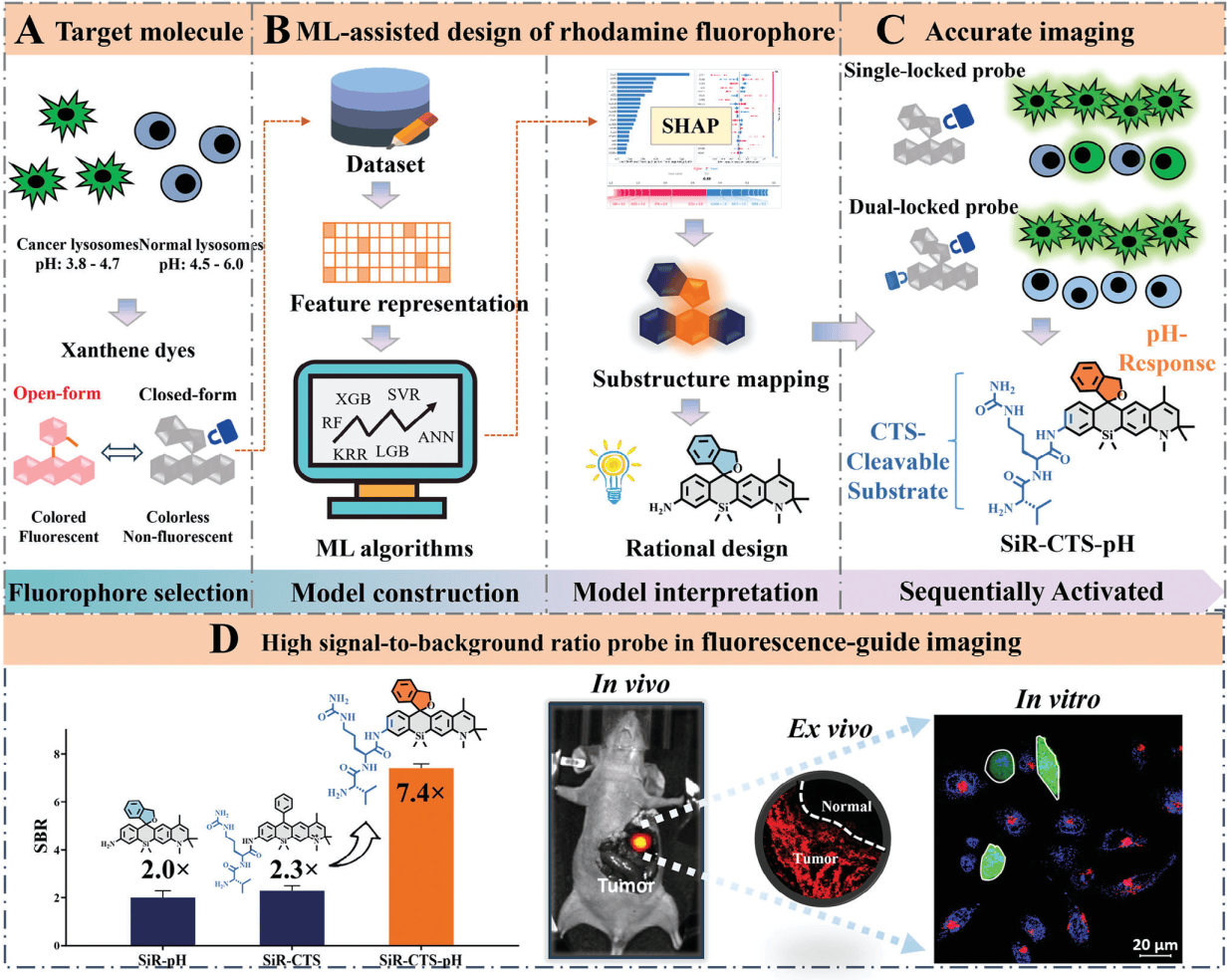
图1 荧光探针的设计理念和应用
研究方法
•
1、机器学习辅助设计
数据收集: 从文献中收集了113种具有实验pKcycl值的氧杂蒽染料数据,并使用简化分子输入线性系统(SMILES)进行结构表示。
特征提取: 使用扩展连接指纹(ECFP)进行结构表征,并进行了特征降维,最终保留了49个重要的特征。
模型训练: 使用六种不同的机器学习算法(KRR、rbf-kernel-based SVR、RF、XGB、LGB、ANN)进行模型训练,并通过十折交叉验证进行模型评估。
模型选择: 根据模型性能指标(R2、RMSE、MAE),选择了XGB模型作为最终的预测模型。
模型解释: 使用SHAP分析对模型进行解释,揭示了分子结构特征对pKcycl值的影响,并指导了新型荧光探针分子的设计。
2、理论计算
使用DFT计算SiR-CTS-pH和SiR-pH的分子构象和电子结构,解释其光谱特性。
使用分子对接技术模拟SiR-CTS-pH与组织蛋白酶的结合模式,解释其响应组织蛋白酶的机制。
3、体外实验
pH响应实验: 在Britton-Robinson (B-R) 缓冲溶液中,测试SiR-pH和SiR-IapH的pH响应能力。
组织蛋白酶响应实验: 在含有组织蛋白酶的缓冲溶液中测试SiR-CTS-pH的响应特性。
细胞成像实验: 在肝癌细胞(HepG2)和正常细胞(HL-7702)中测试SiR-pH、SiR-CTS和SiR-CTS-pH的细胞成像效果,并建立肝癌细胞和正常细胞的混养模型以及三维立体细胞球模型模拟体内肿瘤细胞的生长环境。
细胞毒性实验: 使用CCK-8法测试SiR-CTS-pH和SiR-pH的细胞毒性。
细胞共定位实验: 使用Lysosome Tracker Green评估SiR-CTS-pH在溶酶体中的定位能力。
光稳定性实验: 使用激光扫描显微镜测试Si-Rhodamine-pH和Lysosome Tracker Green的光稳定性。
4、体内实验
皮下肿瘤小鼠模型: 建立皮下肿瘤小鼠模型,并在肿瘤部位注射SiR-pH、SiR-CTS和SiR-CTS-pH,观察其荧光成像效果。
肝癌小鼠模型: 建立肝癌小鼠模型,并分别进行尾静脉注射和原位喷洒SiR-CTS-pH,观察其荧光成像效果。
组织切片实验: 对肝癌小鼠的肝脏进行组织切片,并使用免疫荧光染色和苏木精-伊红 (H&E) 染色,验证SiR-CTS-pH的成像效果。

图2 机器辅助探针设计
研究结果
•
基本信息描述
1. 机器学习模型准确有效
模型能够准确预测氧杂蒽染料的pKcycl值,并成功指导设计了新型荧光探针分子。染料SiR-pH的预测pKcycl值为3.95,而染料SiR-IapH的预测pKcycl值为4.10。此两种染料的预测pKcycl值均低于4.5,适合溶酶体酸激活探针的设计。(图2)
2. 光谱实验结果
染料SiR-pH的实验pKcycl值为3.95,而染料SiR-IapH的实验pKcycl值为4.10。因此,选择SiR-pH作为探针的母体,并引入组织蛋白酶特异性基团Val-Cit,构建双锁探针SiR-CTS-pH。
探针的光谱响应实验结果表明,SiR-CTS-pH能够序列响应组织蛋白酶和pH,实现荧光信号的开启,具有高选择性、响应迅速,灵敏度高等优点,为肝癌的精准治疗提供了新的思路和工具。(图3)
3. 细胞实验结果
无论是在单独培养的肿瘤细胞和正常细胞模型,还是肿瘤细胞和正常细胞的混养模型,亦或是三维立体细胞球模型中,与单因素激活的对比探针相比,SiR-CTS-pH具有更高的SBR和更强的肿瘤细胞识别能力,能够准确区分肝癌细胞和正常细胞(图4和图5)。
使用Lysosome Tracker Green验证SiR-CTS-pH在HepG2细胞中的溶酶体定位,共定位效果良好。
商业染料Lysosome Tracker Green在连续照射10分钟后,荧光强度降低约50%。与商业染料相比,Si-Rhodamine-pH在连续照射10分钟后,荧光强度降低约30%。以上结果表明探针具有良好的光稳定性,适合成像。
4. 体内成像结果
在皮下肿瘤小鼠模型中,SiR-CTS-pH的荧光成像效果明显优于SiR-pH和SiR-CTS,肿瘤与正常组织的荧光强度比值高达7.4,而对比探针SiR-CTS(不具备pH激活能力)的比值为2.3,SiR-pH的比值为2.0。(图6)
在肝癌小鼠模型中,尾静脉注射SiR-CTS-pH后,肿瘤部位的荧光成像效果明显,能够区分肿瘤和正常组织。(图6)
原位喷洒SiR-CTS-pH后,肝上的肿瘤处的荧光信号明显,能够精准地照亮整个肿瘤轮廓,而正常肝组织无荧光。(图7)
使用免疫荧光染色和H&E染色验证SiR-CTS-pH的成像效果,探针区分出来的肝癌细胞与正常细胞的边界与上述两种方法得到的结果基本一致,表明SiR-CTS-pH能够准确识别肝癌组织。(图7)
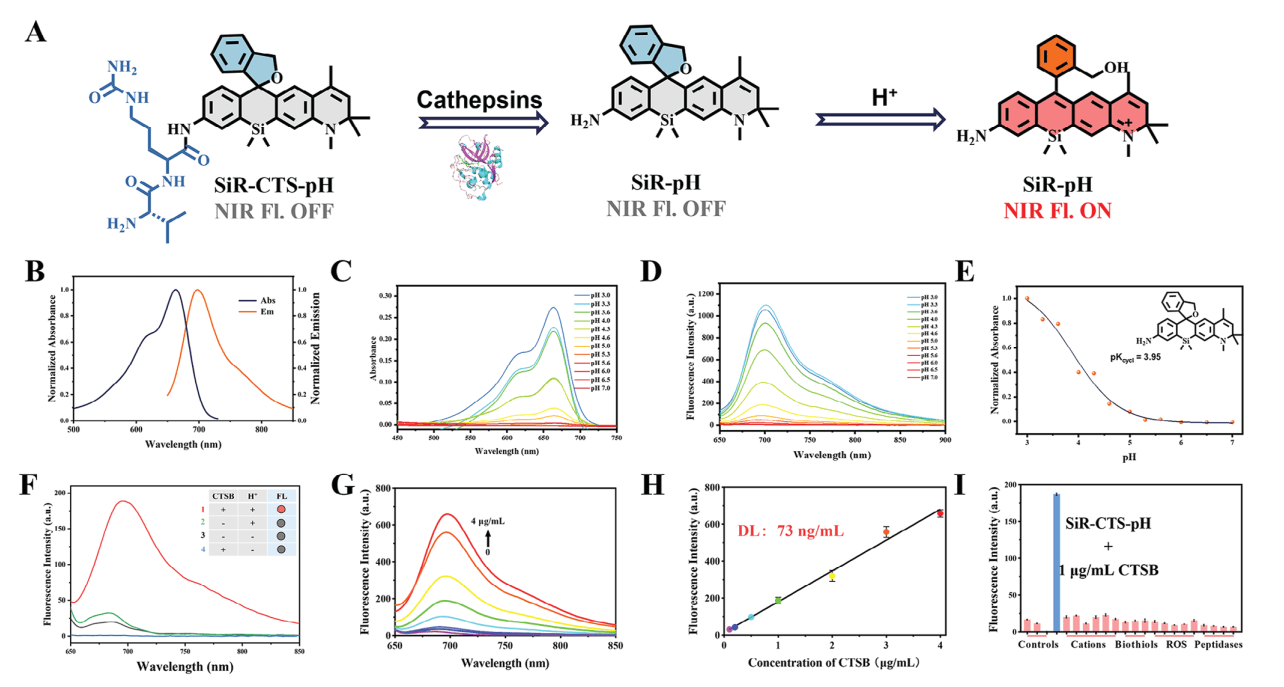
图3 探针对组织蛋白酶和pH的光谱响应结果
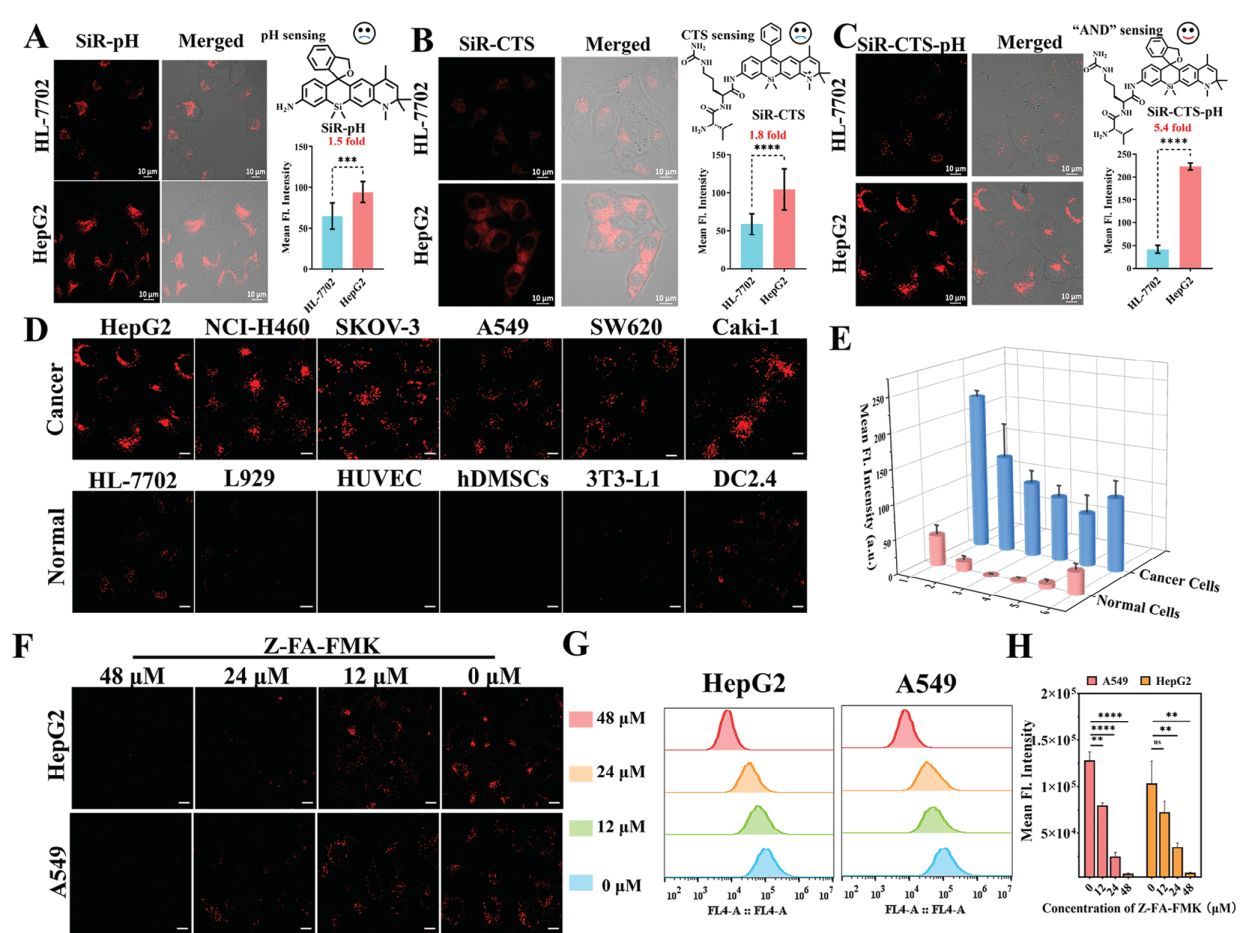
图4 探针对肿瘤细胞的特异性成像能力评估
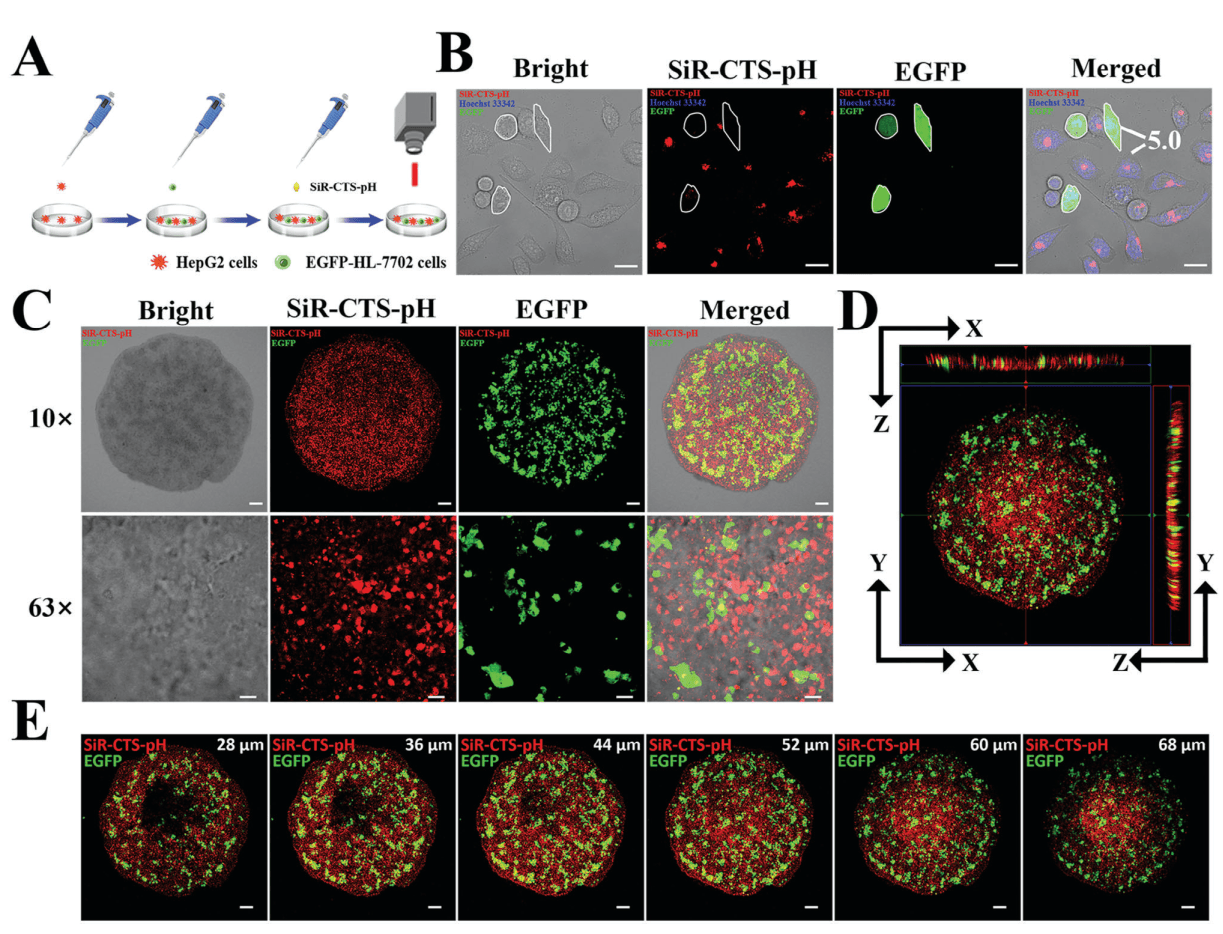
图5 探针在三维立体细胞球模型中区分肝癌细胞的能力
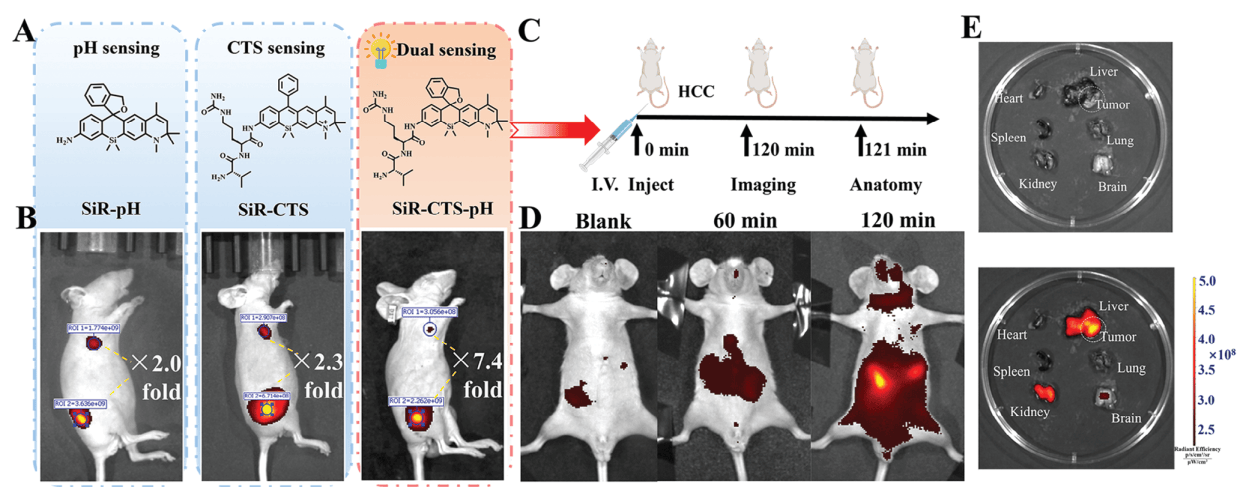
图6 探针在皮下肝癌模型和原位肝癌模型中的成像能力评估
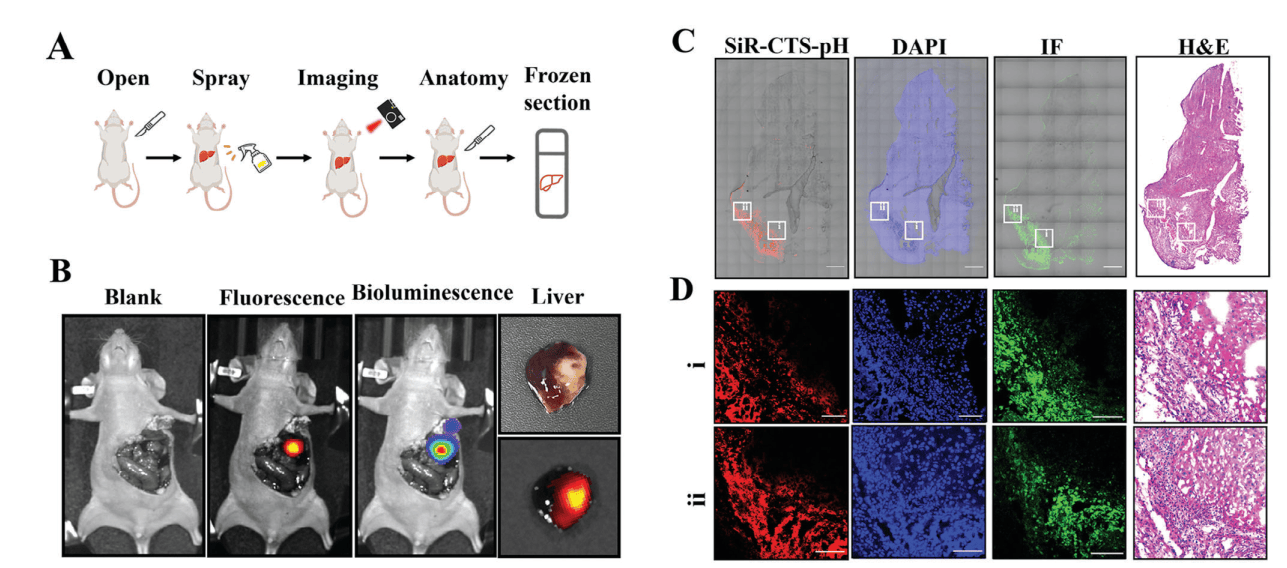
图7 探针在荧光手术导航中的应用
研究讨论
•
总结
Summary
本文展示了机器学习在指导新型荧光探针设计方面的巨大潜力,并成功开发了一种具有高信噪比和优异肿瘤识别能力的双锁荧光探针 SiRCTS-pH,为特异性肿瘤成像和荧光手术导航提供了新的工具和方法。未来需要进一步研究 SiRCTS-pH 在临床应用的可能性,克服临床应用中的困难,最终实现临床转化,造福肝癌患者。
参考文献
[1] Fei-Fan Xiang, Hong Zhang, Yan-Ling Wu, Yu-Jin Chen, Yan ZhaoLiu, Shan-Yong Chen, Yan-Zhi Guo,Xiao-Qi Yu,and KunLi, Machine-Learning-Assisted Rational Design of SiRhodamine as Cathepsin-pH-Activated Probe for Accurate Fluorescence Navigation,Adv. Mater. 2024, 2404828
END
文案 | 陆细刚
排版 | 陆细刚
审核 | 陆细刚
发布|姜笑南
世界生命科学大会
RECRUIT
关注我们,获取生命科学
学界前沿|促进更多的学术交流与合作
业界前沿|促进更快的产品创新与应用
政策前沿|促进更好的治理实践与发展
本文作者可以追加内容哦 !

