7月22日, 信达生物宣布,胰高血糖素样肽-1受体(GLP-1R)/胰高血糖素受体(GCGR)双重激动剂—玛仕度肽在中国2型糖尿病受试者中开展的III期临床研究(DREAMS-1)达成首要终点和全部关键次要终点,展现出降糖、减重双达标及心血管肾脏代谢指标的综合获益。
此前玛仕度肽头对头度拉糖肽治疗2型糖尿病的III期临床DREAMS-2也已达成研究终点,玛仕度肽展现出显著优效于度拉糖肽的降糖疗效,并在减重、心血管代谢指标均展示出了更优越的综合获益。
信达生物计划近期向CDE递交玛仕度肽治疗2型糖尿病的新药上市申请。今年 2 月,玛仕度肽的首个NDA 获 NMPA 受理,用于成人肥胖或超重患者的长期体重控制。

玛仕度肽(IBI362)是信达生物与礼来制药共同推进的一款胰高血糖素样肽-1受体(GLP-1R)/胰高血糖素受体(GCGR)双重激动剂。当前,玛仕度肽共开展了五项III期临床研究,包括:
在中国超重或肥胖受试者中开展的III期临床研究(GLORY-1);
在中重度肥胖的中国肥胖受试者中开展的III期临床研究(GLORY-2);
在初治的中国2型糖尿病患者中开展的III期临床研究(DREAMS-1);
在口服药物治疗血糖控制不佳的中国2型糖尿病受试者中开展的对比玛仕度肽和度拉糖肽的III期临床研究(DREAMS-2);
在中国2型糖尿病合并肥胖的受试者中开展的对比玛仕度肽和司美格鲁肽的III期临床研究(DREAMS-3)
其中,GLORY-1、DREAMS-1和DREAMS-2研究均已达成终点。
此次达到终点的DREAMS-1(NCT05628311)是一项在经单纯饮食、运动干预血糖控制不佳的中国2型糖尿病患者中评估玛仕度肽的有效性和安全性的随机、双盲、安慰剂对照的III期临床研究。研究纳入320例受试者(基线平均HbA1c 8.24%,平均体重 77.7 kg),按1:1:1比例随机分配至玛仕度肽4 mg组(N=106)、玛仕度肽6 mg组(N=106)或安慰剂组(N=108),双盲治疗24周。完成双盲治疗后,玛仕度肽4 mg组和6 mg组受试者分别继续接受玛仕度肽4 mg和6 mg治疗24周,安慰剂组受试者接受玛仕度肽6 mg治疗24周。首要终点为第24周时玛仕度肽4 mg和6 mg在HbA1c相对基线的变化上优效于安慰剂。
有效性数据显示:
首要终点顺利达成,玛仕度肽降糖疗效强劲。基于疗效估计目标,第 24 周时,玛仕度肽 4 mg 组和 6 mg 组 HbA1c 较基线平均降幅分别为 1.57% 和 2.15%,均优效于安慰剂组(0.14%)(P 值均<0.0001)。玛仕度肽组的 HbA1c 降幅疗效维持至第 48 周。
关键次要终点数据显示,玛仕度肽具有降糖、减重双重疗效优势。第 24 周时,玛仕度肽 4 m 和 6 mg 在体重较基线降幅、HbA1c 达标率、体重达标率以及 HbA1c 体重复合达标率*方面均显著优于安慰剂;治疗至第 48 周时,玛仕度肽 6 mg 组体重较基线降幅达 9.6%。
除 HbA1c 和体重外,玛仕度肽还降低餐后血糖、腰围、血压、血脂、转氨酶,以及尿白蛋白肌酐比等心血管及肾脏代谢指标。
安全性数据显示:
整体安全性与耐受性良好,与玛仕度肽既往临床研究结果一致。最常报告的不良事件是胃肠道不良事件,多为轻度或中度。无新增安全性风险。
低血糖事件发生率较低,且绝大多数为1级低血糖(3.0mmol/L≤血糖<3.9mmol/L),无重度低血糖事件发生。
DREAMS-1研究总览图
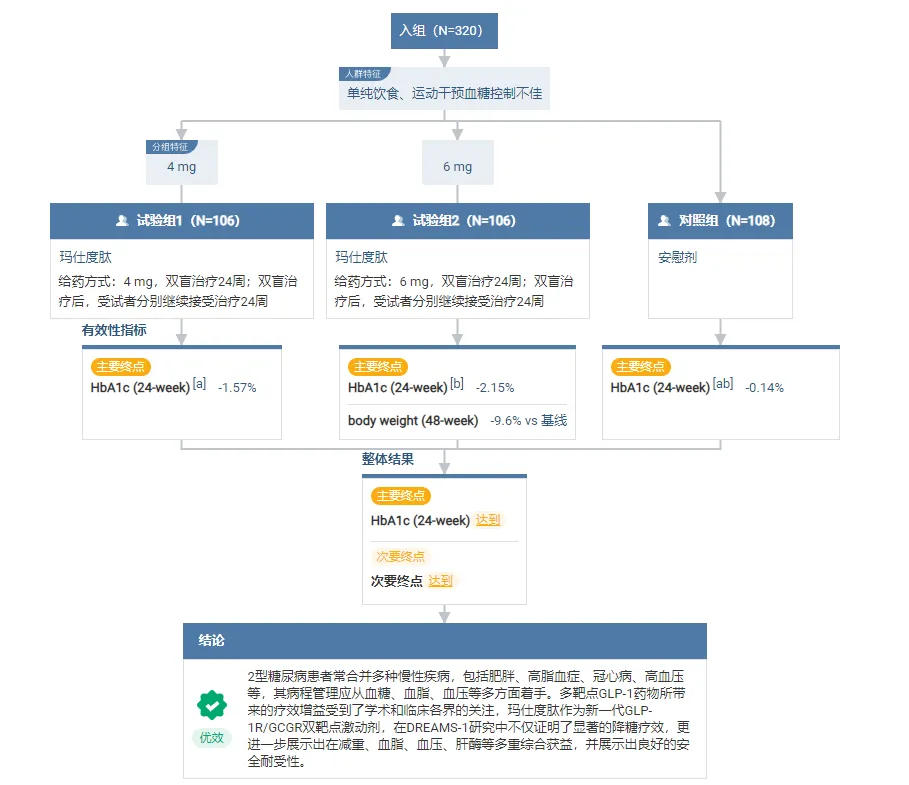
该临床研究的主要研究者、南京大学医学院附属鼓楼医院朱大龙教授表示:“多靶点GLP-1药物所带来的疗效增益受到了学术和临床各界的关注,玛仕度肽作为新一代GLP-1R/GCGR双靶点激动剂,在DREAMS-1研究中不仅证明了显著的降糖疗效,更进一步展示出在减重、血脂、血压、肝酶等多重综合获益,并展示出良好的安全耐受性。期待玛仕度肽早日申报上市,助力中国糖尿病人群血糖达标,兼具多重代谢获益。"
据国际糖尿病联盟2021年发布的全球糖尿病概览,中国糖尿病受试者人数居世界第一,预估2021年超1.4亿人,2045年超1.74亿人。目前针对糖尿病的治疗方案较多,新型降糖类药物的开发除有效控制血糖外,也在探索对糖尿病患者在减轻体重、降低心血管风险、保护肾脏等方面的额外获益。
本文作者可以追加内容哦 !

