研究介绍
•

研究背景
Background
帕金森氏症(PD)是一种常见的神经退行性疾病,影响着全世界600多万人,它是由中脑多巴胺能神经元的丧失引起的,但其根本原因尚不清楚。PD症状最常用多巴胺前体左旋多巴(L-Dopa)或多巴胺受体激动剂治疗,以恢复基底神经节(BG)运动控制通路的活性。然而,由于多巴胺受体在大脑和外周器官的广泛分布,这些药物缺乏特异性,会导致非BG药物的消耗和其他中枢和外周多巴胺系统的干扰。因此,对PD的精确治疗,能够选择性地调节PD影响的回路是非常需要的。操纵特定类型细胞的最有效和精确的方法之一是在感兴趣的组织或细胞类型中特异性表达基因编码重组酶。另一种方法采用细胞类型特异性启动子和/或增强子,但在啮齿动物和灵长类动物模型中,只有一小部分已确定的神经元启动子维持内源性基因表达模式。受能够感染轴突末端的逆行腺相关病毒(AAV)示踪剂发展的启发,研究人员认为可以构建一个靶向和调节特化投射神经元类型的无重组酶系统,包括以下组件:(1)一种逆行的AAV衣壳,可以有效地感染选定的投射神经元的轴突;(2)一种启动子和/或增强子,可以驱动目标投射神经元中有效的基因表达;(3)一种化学发生效应物,可以控制转导神经元的兴奋。重要的是,这种策略不需要基因改造,因此具有在人类临床应用的潜力。在帕金森啮齿动物中,多巴胺缺失导致直接通路活性的深度抑制,而纹状体D1表达多巴胺受体的中棘神经元(D1- msns)的靶向激活有效地挽救了核心运动症状。由于d1 - msn是唯一一种投射到黑质网状部(SNr)的主要纹状体细胞类型,因此它们是实现PD回路特异性调节方法的理想靶点。
研究目的
Objectives
研究人员寻求开发一种无重组酶,逆行的基于aav的策略来精确分离和调节D1-MSNs作为PD的治疗方法。
研究发现
•
实验结果
1、d1 - msn高效逆行AAV衣壳的研制
为了找到针对d1 - msn的有效逆行AAV,研究人员首先测试了当前标准逆行AAV衣壳rAAV2-retro在注入信噪比后转导d1 - msn的能力(图1A)。研究人员在C57BL/6J小鼠中初始注射的结果是raav2 - retrov - hsyn - eyfp对纹状体msn进行稀疏标记。为了提高效率,研究人员对不同血清型的AAV衣壳进行了多轮突变。首先,研究人员将多肽片段“LADQDYTKTA”及其侧翼序列与另外两个用于形成rAAV2-retro Cap蛋白的点突变一起插入到其他4种AAV血清型AAV1/5/6/8的等效位置(图1B)。除AAV5突变体外,所有修饰的AAVs都保持了传染性,但只有AAV8突变体AAV8R获得了d1 - msn逆行感染性的改善。研究人员观察到,与注射raav2 - retrohsyn -EYFP的小鼠相比,注射AAV8R-hSyn-EYFP的小鼠EYFP+ MSNs增加4.860.22倍(图1C和1D)。接下来,研究人员重点研究了一系列提高AAV一般感染性或逆行效率的突变。在测试的14个突变体衣壳中,AAV8R12是最有效的,与rAAV2-retro相比,注射黑素后,AAV8R12标记的msn多7.720.78倍(图1C和1D)。研究人员还观察到AAV8R和AAV8R12在传递到腹侧白质或外侧下丘脑后,对伏隔核的msn进行了强有力的标记,说明这些修饰的AAV衣壳能够转导msn的轴突。
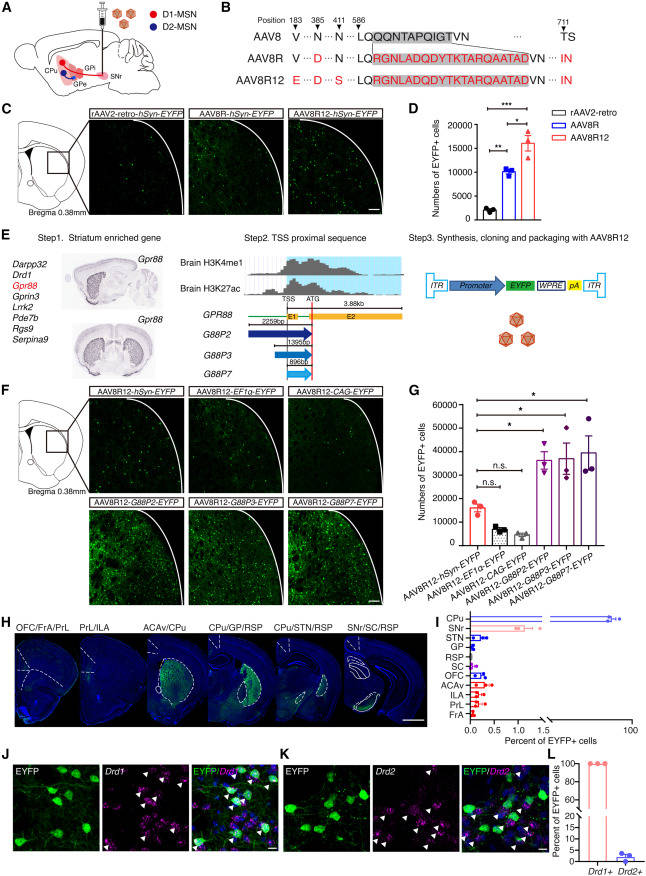
图1 用于D1-MSN的高效逆行AAV衣壳和稳健的MSN启动子的开发
2、d1 – msn强启动子的鉴定
为了找到在msn中诱导高水平基因表达的启动子,研究人员分析了Allen Brain Map基因表达数据库,并鉴定出与其他BG结构相比纹状体表达高度富集的8个基因。对于这8个基因,研究人员检查了与增强子和启动子H3K4me1和H3K27ac相关的两种染色质修饰的大脑图谱。研究人员在转录起始位点周围发现了约2 kb的序列,其中H3K4me1和/或H3K27ac水平较高,并将人类基因组(hg38)等效位置的同源序列克隆到AAV主干中。注射到SNr后,在小鼠中测试了它们驱动报告基因表达的能力(图1E;表S2)。在测试的11个启动子中,与常用的启动子hSyn、EF1和CAG (1F和1G)相比,来自GPR88基因的2259 bp启动子G88P2在msn中表达最高。然后研究人员缩短了G88P2,并制作了两个衍生物G88P3和G88P7,分别长1395和896 bp(图E),并观察到两者的活性相当。在正常递送后,由G88P3和G88P7启动子驱动的表达EYFP的病毒每只小鼠分别标记3.70.66 × 104和3.950.73 × 104 MSNs,而由hSyn启动子驱动的病毒每只小鼠标记1.610.16 × 104 MSNs(图1G)。与小鼠纹状体中Gpr88的内源性表达模式一致,研究人员发现静脉注射AAV-PHP后,EYFP与Drd1和Drd2共染色,但未与小白蛋白(PV)、生长抑素(SST)或ChAT共染色。eB-G88P7-EYFP交付。
接下来,研究人员确定了G88启动子与AAV8R12衣壳一起递送至SNr时的表达模式。在小鼠黑质注射AAV8R12-G88P7-EYFP后,纹状体中有97.68%0.43%的标记神经元。标记神经元分别位于信噪比区和其他上游脑区,分别为1.14%0.16%和1.18%0.41%(图1H和1I)。小鼠神经注射AAV8R12-G88P7-EYFP后,EYFP与Drd1或Drd2的双重标记表明,所有逆行标记的神经元均为Drd1+, <3%的神经元显示Drd2阳性免疫反应(图1J-1L)。据报道,一小部分snr -突出的msn同时表达Drd1和Drd2受体。同样,在Drd1-Cre和Drd2-Cre小鼠中同时注射AAV8R12- g88p7 - eyfp和纹状体注射AAV9-G88P7-DIO-tdTomato证实,在Drd2-Cre小鼠中,AAV8R12标记的snr靶向msn <3%为tdTomato+。总的来说,研究人员发现12.44%2.3%的d1 - msn在注射小鼠中呈报告阳性。然后,研究人员在灵长类动物身上测试了D1-MSN逆行标记系统的有效性。将aav8r12 - g88p53 -mCherry单侧注射到猕猴(Macaca fascularis)的信噪比中,结果显示尾状核和壳核(CPu)的投射神经元得到了强大的标记,CPu中有20.55%的d1 - msn表达mCherry,其他部位的标记量很少(图2A-2D)。报告基因和DRD1或DRD2的双重标记表明AAV8R12只标记d1 - msn(图2E-2G)。总之,这些数据证明了逆行AAV衣壳和启动子组合在d1 - msn中选择性表达的能力。
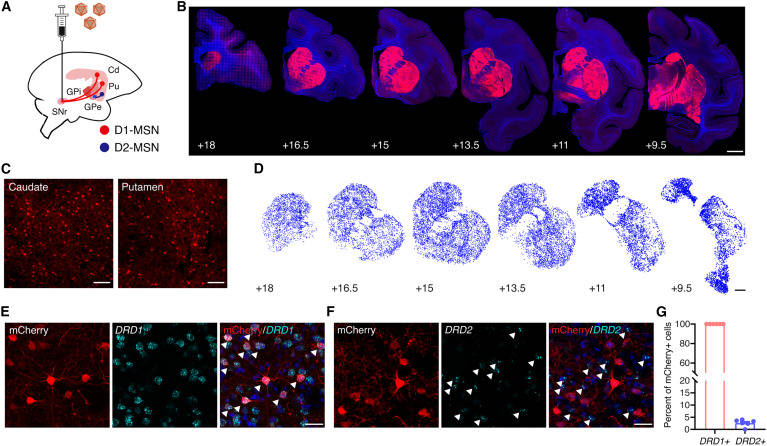
图2 食蟹猕猴神经注射AAV8R12后D1-MSNs的鲁棒标记
3、小鼠BG直接通路的化学发生操作及化学发生效应物的优化
为了测试研究人员是否可以特异性调节转导的msn的活性,研究人员将AAV8R12-G88P3-HA-hM3Dq单侧注射到小鼠SNr中,该基因表达被设计药物(DREADD)效应物hM3Dq特异性激活的设计受体,并在氯氮平n -氧化物(CNO)给药时激活神经元。解剖分析显示,标记神经元大部分位于纹状体,标记神经元均为Drd1+(图3A-3C)。通过切片全细胞电压夹记录,研究人员发现在CNO给药后,AAV8R12-G88P3-HA-hM3Dq-2A-EYFP转导的msn的兴奋性增强,而不影响基础放电率或静息膜电位(图3D和S3B-S3D)。令人惊讶的是,研究人员观察到腹腔内注射(i.p)后的对抗性旋转减少。与生理盐水注射相比,CNO递送量(图3E)。这一结果表明直接通路的抑制或间接通路的兴奋,与单侧纹状体D1-MSNs激活的预测结果相反。根据观察到的逆行AAV感染模式,研究人员推断逆行性旋转可能是激活同侧SNr的结果,SNr是BG的主要抑制输出中心,局部注射的AAV轻度转导(图1H, 1I, 3A)。免疫组织化学分析证实,CNO处理后,黑质c-Fos+细胞显著增加,而生理盐水处理后则没有(图3E)。为了进一步探讨这一观察结果,在单侧神经性AAV分娩后,在同侧纹状体背内侧区域附近颅内给予CNO或生理盐水。通过这种方法,CNO而非生理盐水诱导了相反的旋转,研究人员没有观察到黑质c-Fos+细胞数量的显著变化(图3F)。此外,CNO没有引起接受神经性AAV8R12-G88P3-EYFP注射的动物的行为改变。这些结果表明,由研究人员改良的逆行aav标记的D1-MSNs的化学发生激活足以驱动小鼠的行为变化,但它们也强调了研究人员需要进一步优化研究人员的方法,以允许D1-MSNs在全身配体递送后特异性激活。
为了改进研究人员的方法,研究人员试图确定一种替代的化学发生效应物,它将允许对d1 - msn进行特异性操作,并且与全身配体输注兼容。常用的gq偶联效应物引起细胞Ca2+浓度的升高,与耦合其他第二信使的DREADDs相比,gq偶联效应物在驱动神经元兴奋方面更有效。因此,研究人员想知道一种不同的化学发生效应物rM3Ds,它使用环AMP (cAMP)作为第二信使,可以有效地激活纹状体msn,是否会在全身CNO给药后激活D1-MSN而不激活神经神经元。为了验证这一点,研究人员将AAV8R12-G88P7-rM3Ds-2A-EYFP单侧注射到成年小鼠的SNr中。免疫组织化学和原位杂交(ISH)分析证实,大多数标记神经元位于纹状体,所有逆行转导的神经元均为Drd1+(图3G-3I和S3 G).切片电生理记录显示,CNO给药后,标记纹状体msn的兴奋性增加,但对基础放电率或静息膜电位没有影响(图3J)。研究人员发现,腹腔和颅内(i.c)输注CNO均可诱导反向旋转,且未增加黑质c-Fos+细胞的数量(图3K和3L)。此外,CNO在接受AAV8R12-G88P7-EYFP注射到SNr的动物中没有诱导旋转行为
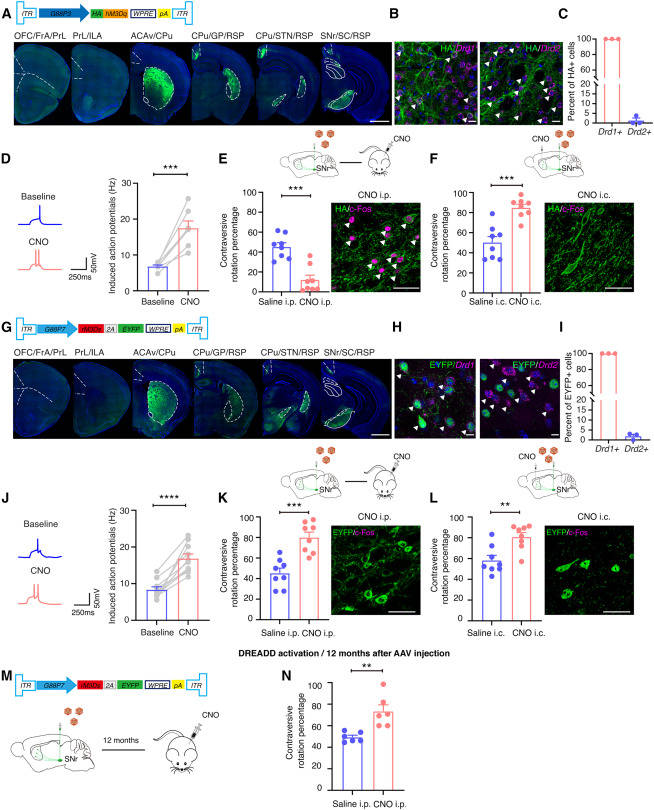
图3 D1-MSNs的化学发生激活可驱动小鼠强健的运动行为
4、猕猴BG直接通路的化学发生操作
尽管非人灵长类动物(NHP)模型在神经科学研究中的重要性,但神经回路标记和操作技术在这些动物中的应用只取得了有限的成功。神经活动的化学发生操作,虽然不是针对特定的神经回路,已经证明了它在猕猴大脑中的有效性。为了在灵长类动物中验证研究人员的BG直接通路调节方法,研究人员将AAV8R12-G88P3-HA-hM3Dq或AAV8R12-G88P7-rM3Ds-2A-EYFP单侧注射到食食猴的信度比中。大部分标记神经元位于中央处理器,纹状体DREADD+神经元均为DRD1+(图4A-4H)。麻醉动物的电生理记录证实,CNO(而非生理盐水)输注后,中央处理器神经元活动增加(图4I-4L)。为了直接评估rM3Ds在D1-MSNs中的表达对其活性的影响,研究人员在小鼠和猕猴体内同时注AAV8R12-G88P7-HA-rM3Ds-2A-Cre和纹状体AAV9-EF1-DIO-ChR2-EYFP。小鼠免疫组织化学分析和切片记录证实ChR2和rM3Ds在纹状体突起神经元中共表达,并显示标记的神经元在光照(473 nm)和CNO下均被激活。麻醉猕猴的体内光标记记录显示,CNO有效诱导转导d1 - msn的神经元活动增加(图4M-4P)。在行为测试中,分别在接受hM3Dq或rM3Ds效应物的猴子中,向尾状核背内侧输注CNO或全身输注CNO,可引起对立性旋转的急剧增加(图4Q-4T;视频S1和S2)。经CNO处理后,研究人员还观察到动物在观察笼顶部隔间的停留时间明显减少,而对角旋转速度明显增加(图4U-4X、S4E和S4F)。在剧烈旋转的速度、总移动距离或静止时间方面没有发现显著差异,并且CNO没有引起未注射猴子的显著行为改变。总之,这些结果支持使用研究人员的方法来精确分离和激活灵长类动物的直接通路投射神经元。
许多潜在的治疗干预措施在最初在啮齿动物模型中证明有效后,在临床试验中失败了。因此,研究人员试图在灵长类动物PD模型中评估研究人员的方法的临床潜力。研究人员首先测试了不同的方法来建立帕金森病NHP模型,并选择在SNc中局部注射1-甲基-4-苯基吡啶(MPP+)来真实准确地诱导猕猴的稳健帕金森病。为避免出现影响SNr D1-MSN轴突治疗性AAV感染的并发症,考虑到MPP+注射到邻近SNc,研究人员修改了检测方案,在输注黑毒素之前逆行注射AAV。然后,研究人员用啮齿动物PD模型证实,相反的测试顺序导致帕金森症状的明显缓解。接下来,研究人员将AAV8R12逆行立体定向注射到成年食蟹猕猴的9个信噪比位点。然后将MPP+单侧注射到SNc中,通过TH免疫组化证实SNc中多巴胺神经元及其中央CPu纤维的丢失。
为了激活猕猴大脑中的DREADD,研究人员使用了去氯氯氮平(DCZ),这是一种有效的rM3Ds脑穿透激动剂,与CNO相比,它的脱靶结合减少。麻醉动物的体内电生理记录显示,DCZ或CNO,而非生理盐水,可诱导MPP+损伤猕猴的神经元活动增加。注射MPP+的猴子表现出典型的pd样症状,包括运动迟缓、震颤、僵硬和姿势异常。通过全身DCZ治疗而不是生理盐水治疗,研究人员观察到所有被试猴子的典型帕金森症状逆转(图6I-6S和S6E-S6H)。首先,研究人员在观察笼中观察到自发运动的增加,活动水平接近MPP+注射前的水平。其次,DCZ治疗后震颤明显减轻或消除。第三,研究人员通过d1 - msn的化学激活观察到运动技能的显著恢复。此外,DCZ的有效剂量(0.3 mg/kg)并没有改变幼稚猴子的运动相关行为。重要的是,在连续8个月的DCZ治疗期间,帕金森症状的缓解是一致的。此外,动物无运动障碍,治疗期间常见肝肾相关因子的血液水平保持稳定。总之,这些数据有力地支持了研究人员逆转帕金森灵长类动物核心疾病表型的方法的安全性和有效性。
接下来,研究人员比较了此方法与左旋多巴的疗效,左旋多巴是帕金森病最常见的治疗方法。虽然研究人员观察到两种方法对帕金森症状的逆转相似,但在给药初期,dcz介导的靶向回路激活显示症状的逆转比左旋多巴更快。在药物达到稳态疗效后,DCZ延长了每次给药后的疗效窗口期,至少在给药后24小时内缓解症状,远远长于临床观察到的左旋多巴的治疗窗口期。研究人员在药物输注24小时后采集脑嵴液样本,未发现可检测到的DCZ水平,提示神经网络动力学发生变化或残留的DREADD配体有显著影响。此外,研究人员的方法没有引起运动障碍样行为,这在长期服用左旋多巴后很明显。至关重要的是,长期(4个月)服用左旋多巴并不影响DCZ的疗效或运动障碍的消失。总之,这些结果显示了研究人员的方法在NHP PD模型中的有效性,并支持其治疗人类PD的可行性。
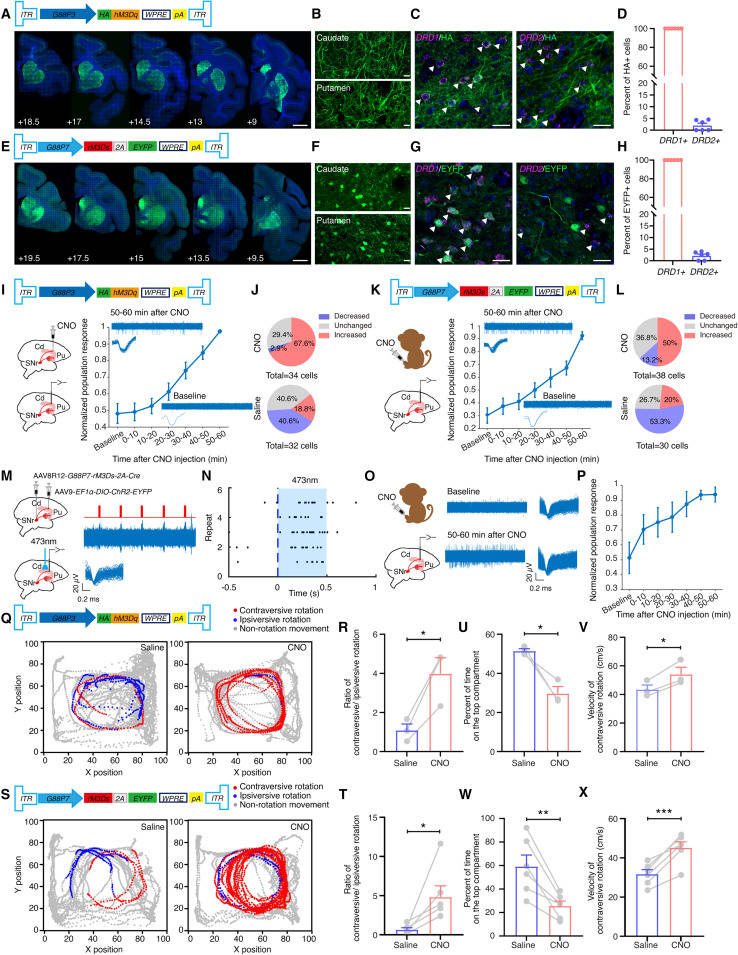
图4 D1-MSNs的化学发生激活驱动了猕猴强健的运动行为
研究结论
•
总的来说,我们开发的精确基因治疗方法有可能改变PD治疗的前景,并为其他脑部疾病的靶向、基于神经回路的治疗策略的发展提供启示。
参考文献
[1] Chen, Y., et al., Circuit-specific gene therapy reverses core symptoms in a primate Parkinson's disease model. Cell, 2023. 186(24): p. 5394-5410.e18.
END
文案 | 李贺轩
排版 | 李贺轩
审核 | 李贺轩
发布|姜笑南
世界生命科学大会
RECRUIT
关注我们,获取生命科学
学界前沿|促进更多的学术交流与合作
业界前沿|促进更快的产品创新与应用
政策前沿|促进更好的治理实践与发展
本文作者可以追加内容哦 !

