
研究介绍
•
研究背景
Background
肿瘤进化是以一个或者多个细胞的转化开始的。恶性转化之前有随机分布的癌症基因的突变,它们会导致形态正常的组织克隆扩增,但克隆转化成恶性肿瘤的机制还不清楚。虽然CRISPR筛查是研究体内克隆生长的有力工具,它们仅限于简单的读数,比如增殖,它是基于所有组织细胞种类的平均值。在正常上皮组织中遗传受干扰的克隆和肿瘤发生的监测需要可以检测基因干扰在所有细胞种类中的转录组结果的组织范围的平台。
研究目的
Aim
为了理解克隆扩增和它在促进恶性转化中的作用,用单细胞CRISPR策略检测克隆扩增和肿瘤发生的分子过程。
研究方法
•
1、靶基因的选择与sgRNA设计:500个sgRNA被选为初始文库。其中50个是非靶向对照gRNA。每个基因对应3个sgRNA。
2、CROP-mCherry载体构建:原始CROP-seq-Guide-Puro载体中的抗嘌呤霉素基因盒被替换成mCherry序列。
CRISPR sgRNA效率:选11个代表高、中、低富集程度组的sgRNA,感染B6.Cas9 角质形成细胞测定sgRNA效率,由indel频率百分比表示。
3、加权基因共表达网络分析(WGCNA)被用来检测细胞聚类中协同变化的基因模块。
4、Visium空间转录组被用来看肿瘤的空间结构。
5、免疫细胞的去除:CD4/CD8 T细胞是通过腹腔注射大鼠anti-mouse CD4/anti-mouse CD8单克隆抗体去除的。巨噬细胞是通过富强注射大鼠anti-mouse CD15抗体去除的。对照组小鼠接受大鼠IgG抗体。
研究发现
•
1. 体内单细胞CRISPR筛查
为了用体内单细胞CRISPR策略监测克隆扩增,作者调整了CRISPR液滴测序(CROP-seq)系统,用mCherry使被感染的细胞能够被流式细胞仪筛选(图1a)。作者选了人类头颈鳞状细胞癌和皮肤鳞状细胞癌的150个最频繁的发生改变的基因(图1a,b)。用内超声引导显微注射把慢病毒文库递送到E9.5小鼠胚胎的羊膜腔中,感染表达Cas9的胚胎单层表面外胚层,引入癌症基因的失去功能型突变。在产后4天(P4)和60天(P60),作者收集了表皮组织,分类得到mCherry阳性感染细胞,用单细胞测序(scRNA-seq)检测基因表达谱并获得sgRNA属性(图1a)。全组织包埋免疫荧光图片确认了表皮中的mCherry 阳性细胞聚类(图1c)。结果得到了P4和P60小鼠皮肤中9-10个不同的包含sgRNA的细胞种类,包括表皮干细胞(EpSCs),位于基底细胞之上的细胞(suprabasal cells),毛囊细胞,皮脂腺,T细胞和巨噬细胞 (图1d,e)。经典标记基因在相应的聚类中展现特异表达(图1g)。sgRNA在这些聚类中都被检测到(图1f)。总的来说,这个体内单细胞CRISPR策略靠结合单细胞转录组和sgRNA捕获为研究组织范围的表皮中的基因功能提供了一个有力工具。
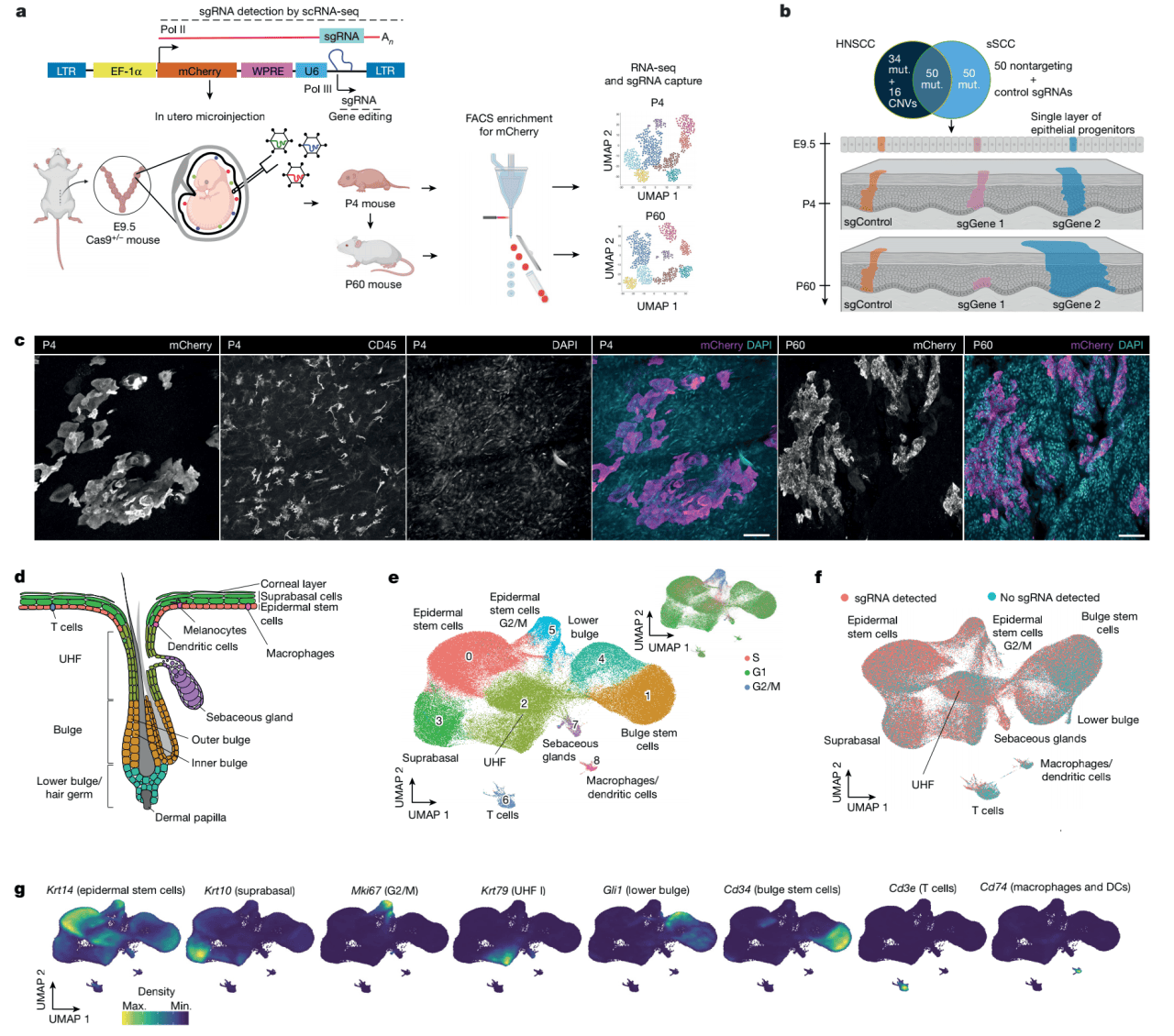
图1 体内单细胞CRISPR筛查
2. 克隆扩增汇聚到TNF
他们计算P4和P60时间点相对于初始文库的全部sgRNA 富集水平。与人类正常皮肤的发现一致,P60表皮展现靶向Fat1, Notch1, Trp53,Notch2,Ryr3和Xirp2的sgRNA强富集(图2a)。相反,靶向癌症中15个扩增的拷贝数变异的sgRNA,比如Trp63,是在消耗最强的sgRNA中的(图2a)。
这个系统层面策略使他们能够研究多个癌症基因突变共有的基因编程。为了系统性检验共有的信号通路,他们对P60皮肤细胞群体使用了WGCNA,发现由TNF信号基因模块主导,它出现在6个聚类中(图2f)。
为了探究TNF信号通路是否和扩增速率有关,他们首先根据TNF EpSC基因模块表达将干扰聚类(图2g)。他们观察到以模块基因高表达为特征的聚类1和2展现出比聚类3更高的扩增速率(图2h)。为了证实汇聚于TNF信号通路,他们比较最高的5, 10 和20扩增干扰与位于平均的或最低的5,10和20干扰的基因表达,发现在每一组比较中,TNF信号通路是最富集的通路(图2i)。总的来说,作者表示尽管癌症基因参与广泛的生物学过程,形态正常上皮的克隆扩增汇聚于一条能够诱导TNF信号模块的共同通路。
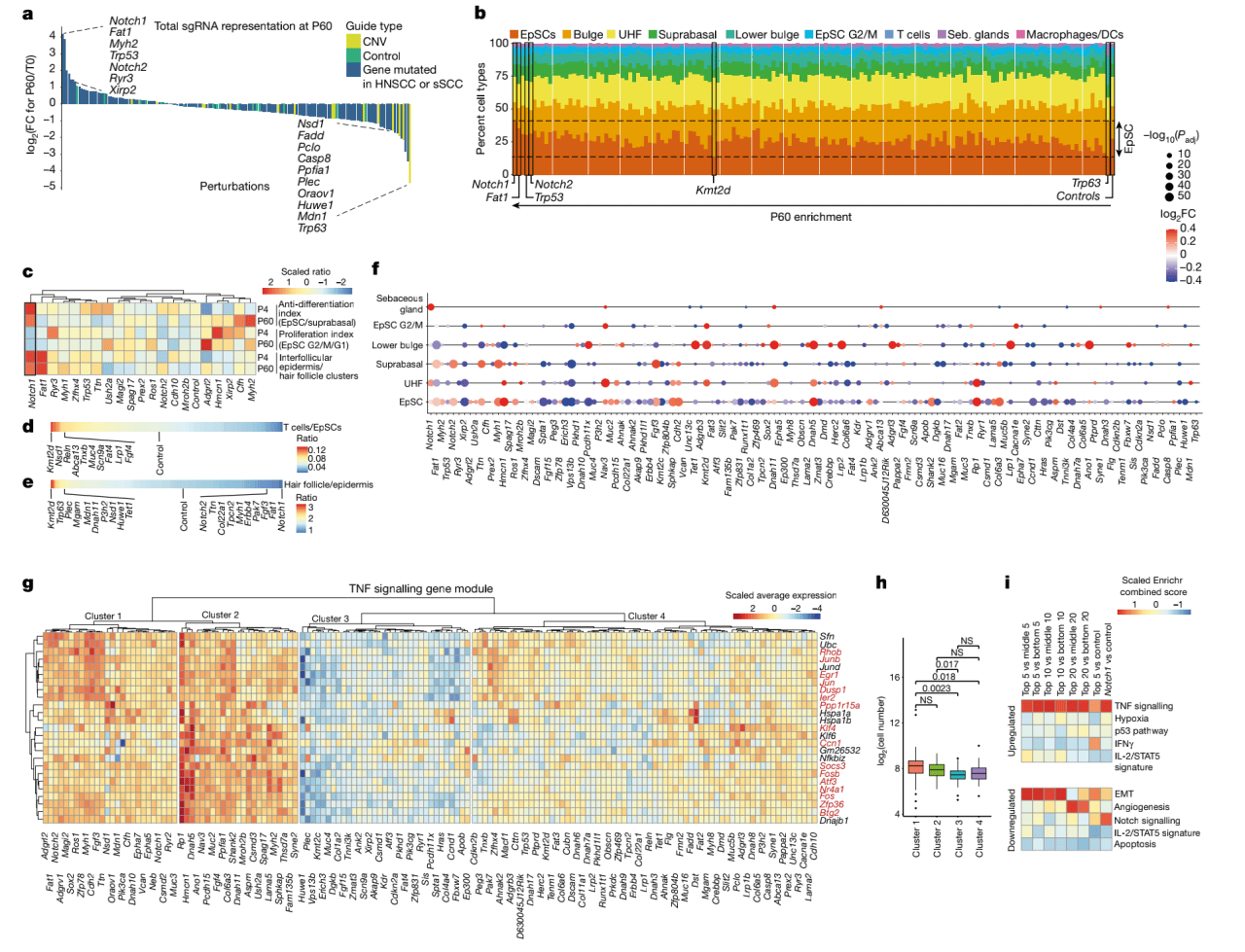
图2 上皮中的克隆扩增汇聚到TNF信号
3. TNFR1和巨噬细胞依赖性
在P60小鼠皮肤中,受体Tnfrsf1a主要表达在EpSC和凸起干细胞中(图3a)。Tnfrsf1b仅表达在T细胞中,TNF主要是由巨噬细胞分泌的(图3a)。配体受体相互作用分析支持从巨噬细胞和T细胞到EpSC的TNF信号通路(图3a)。
为了实验检验TNF信号通路是否直接介导形态正常上皮的克隆扩增,他们将Cas9小鼠与Tnfrsf1a+/− 小鼠,并用内超声引导显微注射来靶向E9.5胚胎的150个癌症基因。然后对比野生型和Tnfrsf1a+/− 小鼠的P60皮肤的扩增速率检验哪一个癌症基因干扰展现TNFR1依赖的克隆扩增(图3b,c)。在P60时的top 20富集的sgRNAs中, 除3个以外其他干扰对于克隆扩增都高度取决于TNFR1,表明TNF信号通路在介导正常上皮克隆扩增有广泛作用(图3c)。
为了探究免疫细胞作为TNF来源促进克隆扩增的程度,作者接下来研究巨噬细胞和T细胞,两者都能够表达TNF(图3a)。在靶向E9.5胚胎中的150个癌症基因后,他们从P4到P60选择性去除巨噬细胞或T细胞并检测P60时的sgRNA表现。去除巨噬细胞导致top20富集的干扰扩增速率一个小但一致的减弱 (图3f–h)。总的来说,TNFR1依赖和巨噬细胞去除的数据支持了TNF信号模块在正常上皮克隆扩增中的功能并建立了这个模块作为癌症基因突变下游的完整通路。
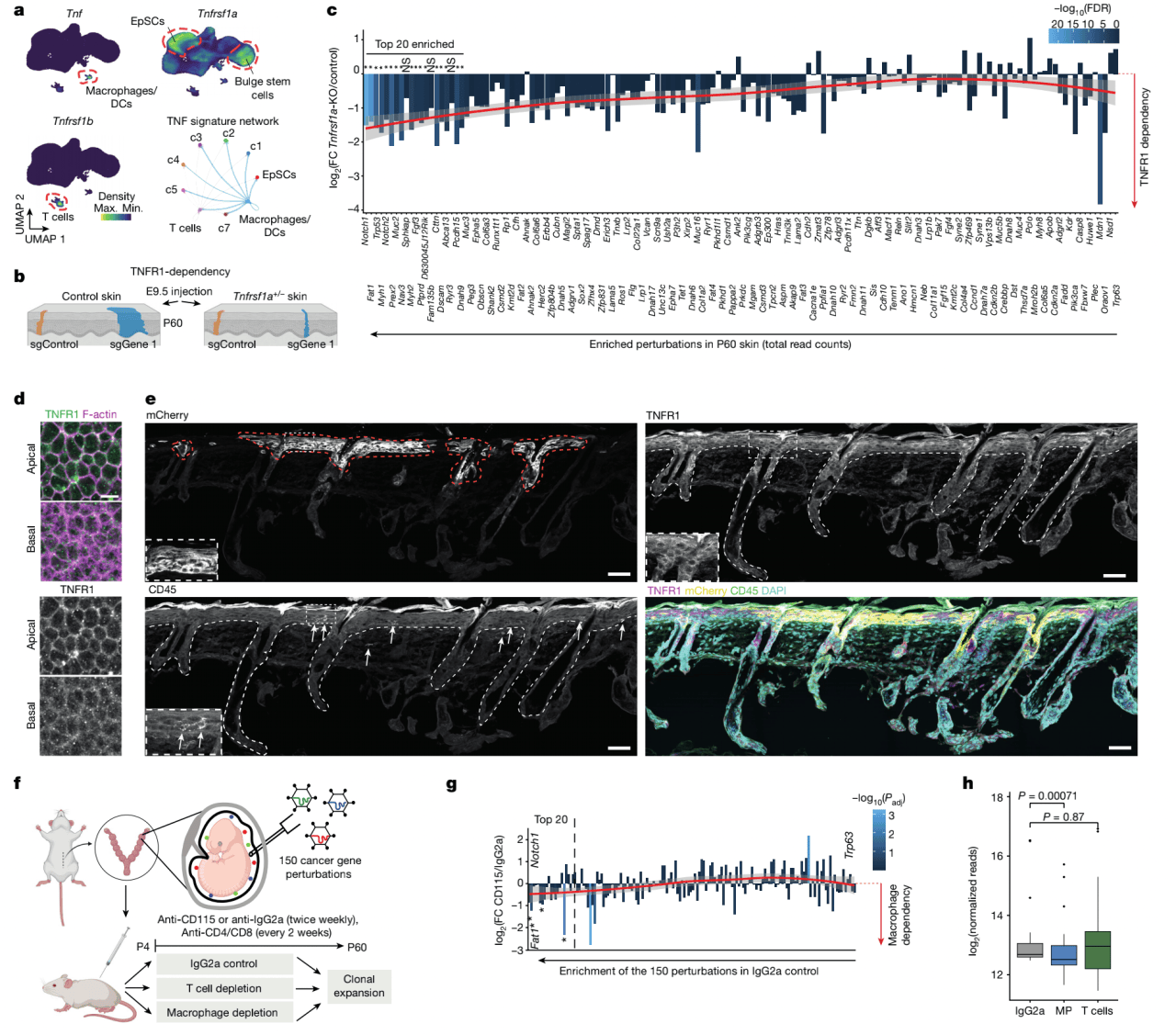
图3 克隆扩增是通过TNF信号介导的
4. 癌症中的自分泌TNF信号
作者接下来探究TNF信号是否导致了从克隆扩增到肿瘤发生的转变。他们将靶向150个癌症基因的sgRNA文库注射E9.5。在P60时,他们用DMBA和TPA在克隆扩增的小鼠皮肤上诱导化学致癌12周。他们收集168个肿瘤捕获sgRNA并对mCherry阴性肿瘤细胞进行scRNA-seq分析,揭示不同的肿瘤细胞聚类,包括基底、分化和cycling肿瘤细胞。与人类皮肤鳞状细胞癌(sSCC)的报道一致,他们也观察到了一种肿瘤特异角质形成细胞(TSK),表达标记基因如Mmp9和Mmp10(图4a,b)。然后作者用互反PCA比较了P60 EpSC和肿瘤细胞,观察到TNF模块基因在肿瘤中下调(图4c,d)。 然后作者研究TSK聚类,因为它的位置是在侵袭前沿,暗示它可能参与肿瘤发展。他们发现8.5% TSK聚类稳定表达内源TNF(图4e)。TNF表达和TSK标志物比如 Mmp10 还有TGF和 IL-1重合(图4c,d)。TGF和 IL-1之前被报道参与人类上皮细胞中TNF信号诱导的自分泌,因此肿瘤发生可能转向TNF自分泌模式。他们确认了TNF在KRT阳性基底肿瘤细胞中的蛋白表达(图4g)以及配受体相互作用的探究进一步表明可能存在TNF在TSK中自分泌(图4f)。和TNF阴性的TSK相比 TNF阳性的TSK中TNF信号和EMT是最上调的,但只有3个TNF信号基因与TNF信号基因模块中的重合(原文扩展数据图6j),表明癌症相关的TNF基因编程和克隆扩增中的TNF模块是不同的。总的来说,这些发现表明在前沿的TSK中一个不同的TNF自分泌编程被诱导。 Visium空间转录组显示 Mmp10 阳性TSK位于入侵前沿,形成入侵巢穴和在肿瘤基底的标志性入侵前沿,而 Mmp10 阴性TSK位于分化区域(图4h-j)。
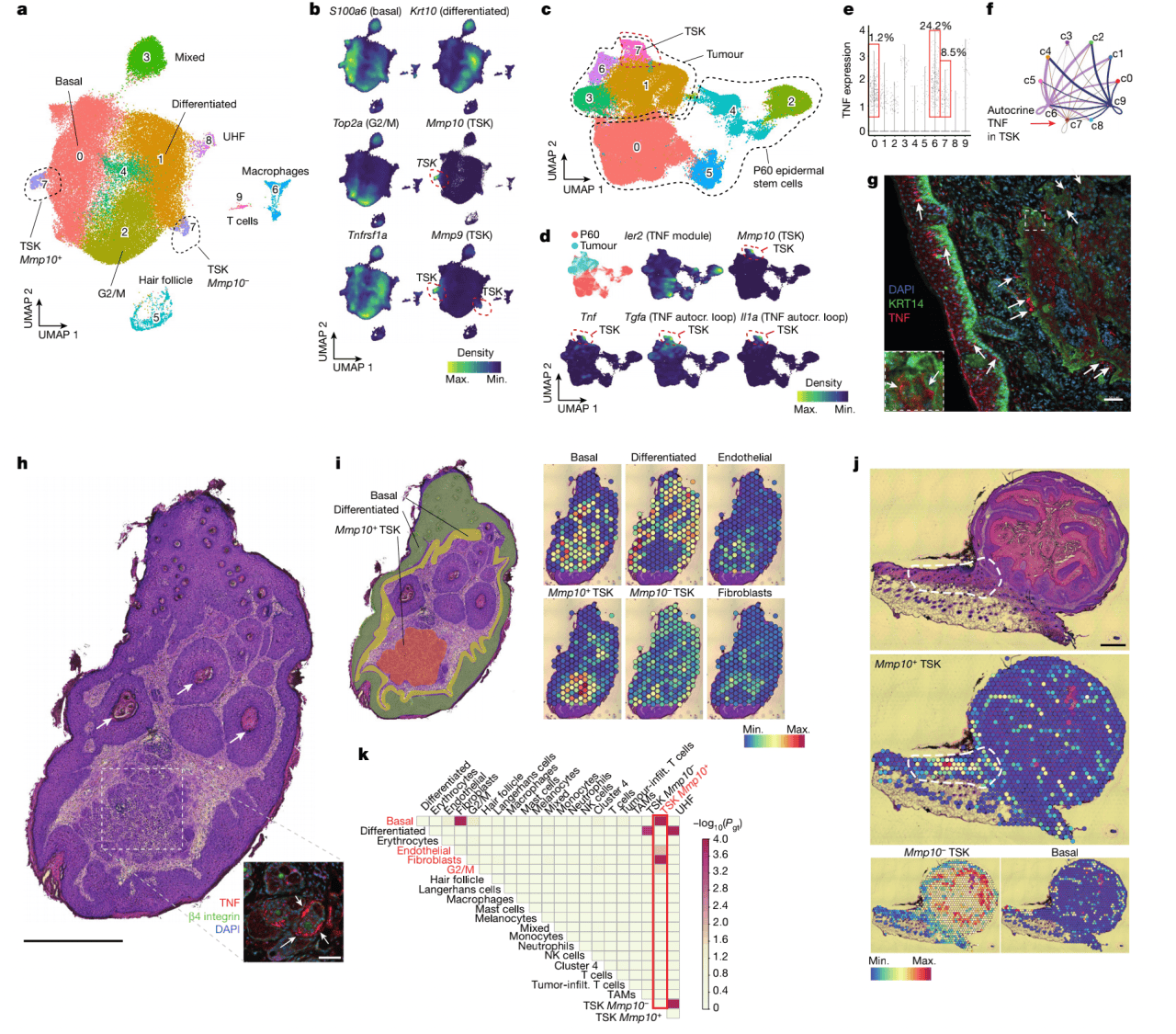
图4 癌细胞转变到TNF自分泌基因编程
5. 克隆扩增和肿瘤发生
为了探究克隆扩增和它在细胞转化中的作用,作者将168个肿瘤中每个肿瘤的sgRNA扩增子进行测序,计算每个sgRNA表现(图5a)。总的来说,他们发现Notch1, Fat1, Trp53, Zmat3和Ahnak在肿瘤中的表现最高(图5b)。他们然后根据归一化到P60皮肤的sgRNA表现的肿瘤sgRNA表现计算出选择分数。他们关注具有高P60或者肿瘤覆盖率的Top60干扰,观察到Zmat3, Prkdc, Myh8, Kdr, Dnah3和Ahnak展现出最高的阳性选择率(图5c),相反,Dscam, Zfhx4, Ttn和Fgf3展现最强阴性选择率,表明这些干扰反而抑制肿瘤发生(图5c)。为了评估是否共同的通路赋予易于转化的倾向,他们接下来检测了P60 EpSC中阳性选择和阴性选择的干扰之间的基因表达变化(图5c)。分析显示和EMT相关的通路显著富集,表明阳性选择干扰已经在P60展现出易于侵袭的特质(图5d)。
作者假设在体内从克隆扩增到早期组织结构的改变可能是由上皮TNF诱导的。他们将设计的慢病毒TNF表达载体注射入E9.5胚胎使上皮细胞表达TNF。P4时表达TNF的克隆展现明确基底膜(图5i,j)。然而随着时间,TNF表达的克隆出现不正常,包括表皮过度增殖(图5g,k)和上皮内陷(图5l)。在P27小鼠中,他们观察到基底膜展现部分或者全部散布的表达TNF的克隆,导致侵入到周围组织(图5m)。总的来说,这些发现为上皮TNF基因编程足够诱导EpSC侵袭特性提供了直接体内证据。
最后,为了探究TNF-TSK轴在人类SCC中的重要性,他们测试了TSK标志物是否能够将SCC病人总体生存期分层并创建了一个TSK特征,使头颈部鳞状细胞癌病人的总生存期分层(图5n)。
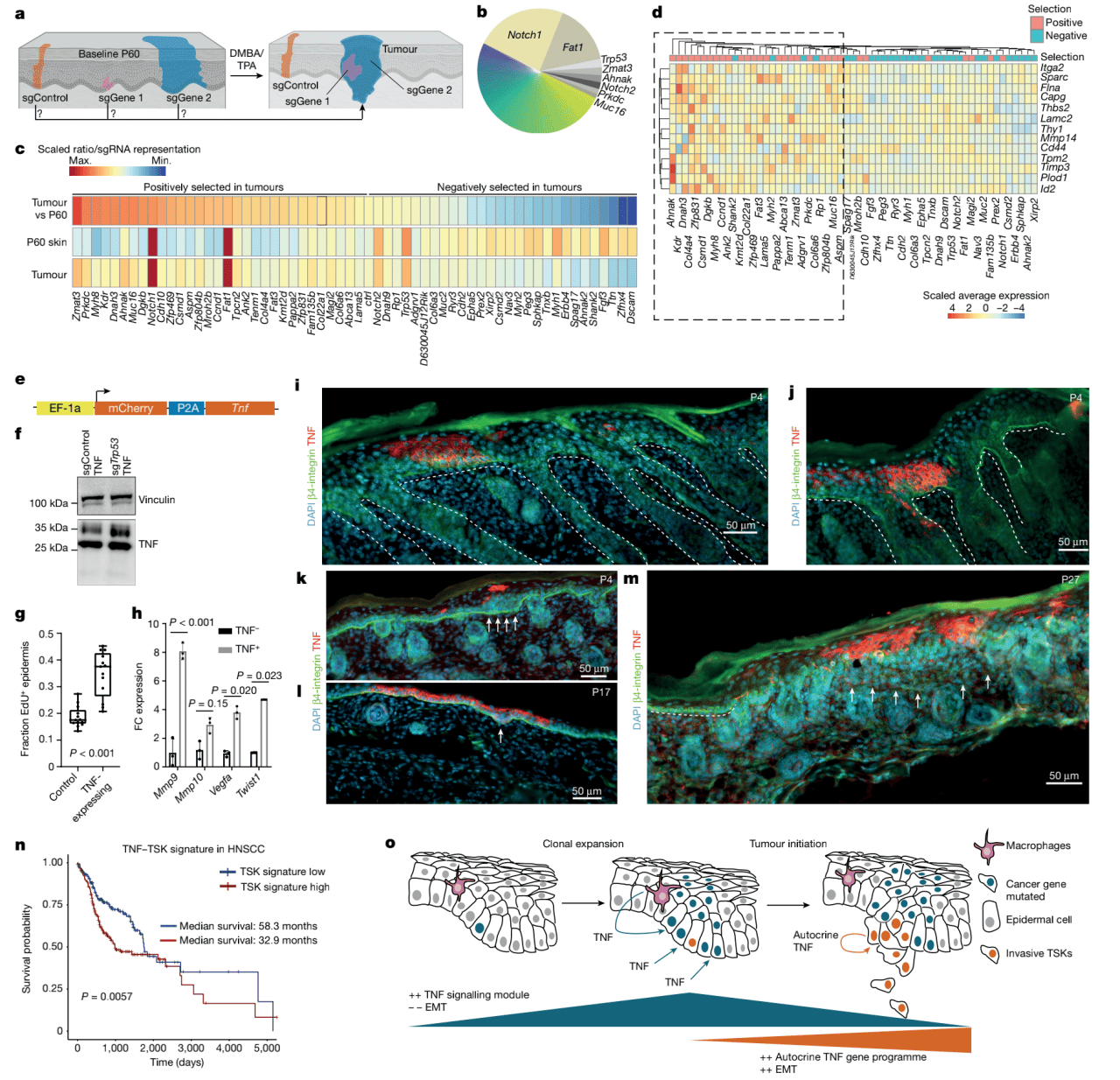
图5 上皮TNF诱导入侵特性
研究讨论
•
作者建立了一个体内单细胞CRISPR平台在单细胞转录组分辨率下系统性分析150个癌症基因干扰的克隆扩增。由于自分泌TNF能够诱导EpSC和人类癌症的入侵特性,自分泌TNF可以作为肿瘤发生的一个关键过程。因此利用自分泌TNF肿瘤的特定弱点可能可以作为潜在的治疗途径和引导靶向自分泌TNF抑制剂开发。
总结
研究意义
这个研究表明体内单细胞CRISPR在哺乳动物组织中的应用,揭示了TNF信号模块促进上皮组织克隆增生。相反,在肿瘤发生时TNF信号模块下调,而TSK转换到TNF自分泌基因编程。体内TNF基因编程能够介导入侵特性。总的来说,这个研究揭示了肿瘤进化中的不同TNF编程,强调了理解上皮中克隆扩增和肿瘤发生的关系的重要性。
参考文献
[1] Renz, P. F., Ghoshdastider, U., Baghai Sain, S., Valdivia-Francia, F., Khandekar, A., Ormiston, M., Bernasconi, M., Dur, C., Kretz, J. A., Lee, M., et al. (2024). In vivo single-cell CRISPR uncovers distinct TNF programmes in tumour evolution. Nature, 10.1038/s41586-024-07663-y. Advance online publication.
END
文案 | Linsey
排版 | Linsey
审核 | Linsey
发布|姜笑南
世界生命科学大会
RECRUIT
关注我们,获取生命科学
学界前沿|促进更多的学术交流与合作
业界前沿|促进更快的产品创新与应用
政策前沿|促进更好的治理实践与发展
本文作者可以追加内容哦 !

