今日,国家药监局发布关于同意在北京上海开展优化创新药临床试验审评审批试点的批复:经审核,同意在北京、上海开展优化创新药临床试验审评审批试点。这也是自优化创新药临床试验审评审批试点工作方案印发以来首批过审的试点区域。
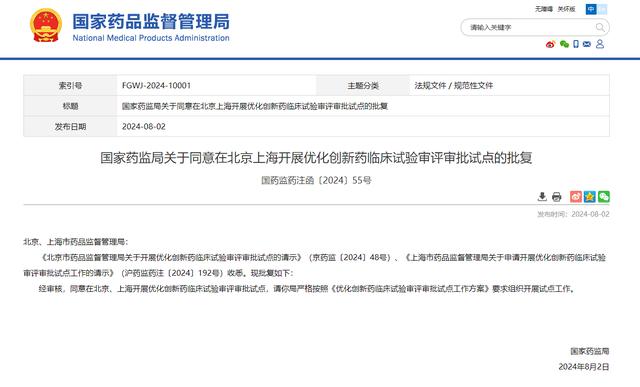
日前,国家药监局印发优化创新药临床试验审评审批试点工作方案的通知。通知要求,优化创新药临床试验审评审批机制,强化药物临床试验申请人主体责任,提升药物临床试验相关方对创新药临床试验的风险识别和管理能力,探索建立全面提升药物临床试验质量和效率的工作制度和机制,实现30个工作日内完成创新药临床试验申请审评审批,缩短药物临床试验启动用时。
从通知纳入试点工作实施步骤来看,共分为“试点区域申请”“试点机构申请”“试点项目申请”“审评审批”“启动实施药物临床试验”五步。此次北京、上海获批试点区域,仅仅只是实施试点工作的第一步。
在此之后,当地临床试验机构需建立完善相关工作制度,向所在地省级药品监督管理部门提出试点申请,省级药品监督管理部门审核确认。
若当地临床试验机构符合要求,符合要求的申请人可自愿申报试点项目。试点区域省级药品监督管理部门商药审中心,在收到试点申请后5个工作日内向同意推荐的试点项目申请人发送项目确认书并抄送试点机构,反之则不纳入试点。
经确认的试点项目,药审中心在受理临床试验申请后30个工作日内完成审评审批,并通过药审中心网站通知申请人审批结果。
最后,申请人与试点机构开展高效合作,于临床试验申请获批后12周内启动临床试验(第一例受试者签署知情同意书),并在临床试验全过程实施风险管理。
从时间安排及预期成果来看,此次北京、上海试点工作将为期一年,且需至少完成10个品种的临床试验申请审评审批并启动临床试验。试点工作将于2025年1月开展中期评估,并于2025年7月总结试点工作经验。
舒泰神/香雪制药/睿智医药
$舒泰神(SZ300204)$:公司以自主知识产权创新药物,特别是生物药物的研发、生产和营销为主要业务,致力于研发、生产和销售临床需求未被满足疾病的治疗性药物,产品包括创新生物药、特色化学药,涉及神经系统、肠道系统等众多治疗领域。排名前四的战法少部分在参与
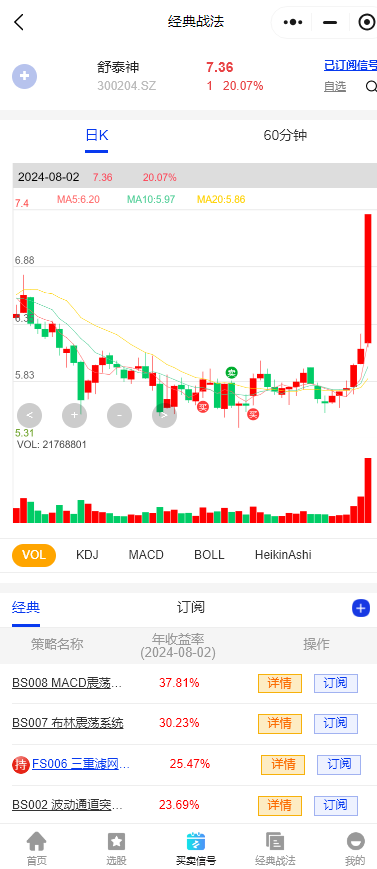
$香雪制药(SZ300147)$:公司是以中药制造为主营业务。公司主导产品之一抗病毒口服液为纯天然植物配方,是公司首创的国家级新药。近日,公司子公司广东香雪精准医疗技术有限公司申报的TAEST16001注射液被国家药监局药品审评中心纳入突破性治疗品种名单。TAEST16001注射液拟用于治疗组织基因型为HLA-A*02:01,肿瘤抗原NY-ESO-1表达为阳性的软组织肉瘤。排名前四的战法都在参与
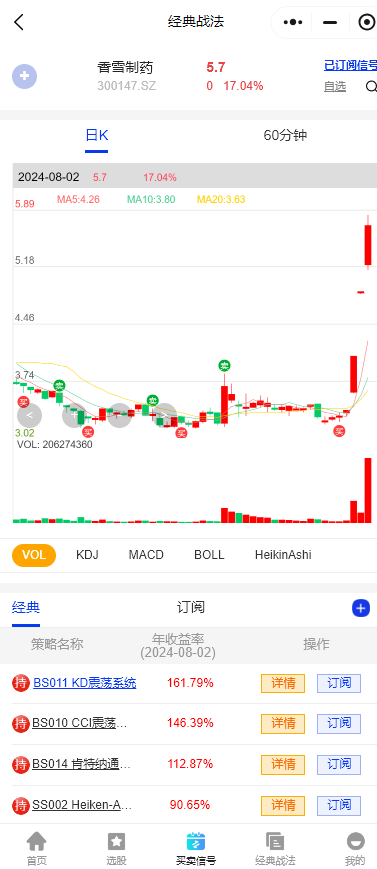
$睿智医药(SZ300149)$:公司是一家拥有领先水平的生物药、化学药一站式医药研发及生产外包服务提供商,主营业务包含两大业务板块,分别为医药研发及生产服务(CRO/CDMO)、微生态营养与医疗。排名前四的战法一半在参与
注:以上仅为谱数的经典战法数据统计结果,供大家参考,股市有风险投资需谨慎。
本文作者可以追加内容哦 !

