
引言
从化疗药物,到靶向药物,再到免疫治疗药物。
肿瘤日渐成为危害人类健康的“头号杀手”,近年来全球恶性肿瘤发病率、死亡人数持续上升,人类与之的战争从不停歇,在肿瘤药物治疗史上的三次革命记录了前进的步伐。
20世纪40年代,化疗药物开始兴起。像紫杉醇、吉西他滨、顺铂等延长了不少患者的寿命。但同时,它们均具有较强的副作用,在杀死癌细胞的过程中,也杀死了正常细胞,可谓是“杀敌一千,自损八百”。
于是,靶向药物应运而生。
靶向药物可以通过精确瞄准癌细胞靶点发挥作用,但若是靶点基因发生突变,药物就会失去目标,丧失疗效。继而又开始了第三次革命——免疫治疗药物,它是利用人自身的免疫体系去杀死癌细胞。

肿瘤的形成:免疫逃逸的结果
在明白免疫治疗药物的作用原理前,我们首先要搞清楚肿瘤的机制。用一句话简单概括来讲——肿瘤是免疫逃逸的结果。
根据肿瘤“免疫编辑”学说,肿瘤在人体内大致可以分为三个阶段:
首先,是清除状态,当人体内出现新生肿瘤细胞时,其具有较强抗原性,容易被我们的免疫系统识别并通过非特异性免疫和特异性免疫清除。
但并不是所有的肿瘤细胞都能被顺利杀死,一些变异的肿瘤细胞通过降低抗原表达等手段逃过“免疫监视”。而在免疫系统压力下又不能过度增殖,于是人体内就进入第二阶段——平衡状态。
这种平衡状态是动态的,肿瘤细胞的变异时刻在进行,当达到一定程度时,就打破了平衡,进入最终阶段——逃逸状态,肿瘤细胞已经将自己进化武装,免疫系统失去了对它的判断,不能正常杀死它,这就是一整个流程。
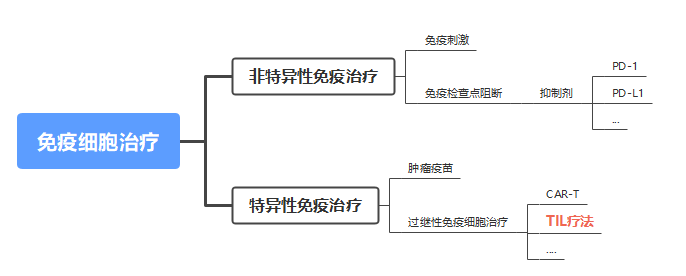
而免疫治疗药物则是重新激活人体免疫系统,也对它进行改造,使其能应突变后的肿瘤细胞。免疫细胞治疗大致可以分为两类,分别是非特异性免疫治疗和特异性免疫治疗。
其中,非特异性免疫治疗又可继续分为免疫刺激、免疫检查点阻断。大名鼎鼎的PD-1、PD-L1就属于免疫检查点抑制剂。
特应性免疫治疗则可继续分为肿瘤疫苗、过继性免疫细胞治疗,当下最火热的CAR-T就属于过继性免疫细胞治疗这一赛道,本文将具体介绍同一赛道的TIL(肿瘤浸润淋巴细胞)疗法。

实体瘤的肿瘤异质性及高度抑制的免疫微环境
说起免疫细胞治疗,大家都会想到CAR-T,目前CAR-T可以说是其中最为火热的赛道,技术也最为成熟。
然而,全球已获批上市的多款CAR-T药物适应症均集中在血液肿瘤领域,却在实体瘤的治疗上屡遭挫折。其主要原因就是,实体瘤具有高度的肿瘤异质性和高度抑制的免疫微环境。
异质性是指看起来这是一个肿瘤,其实里面存在不同的肿瘤亚群,因为肿瘤经过多次分裂增殖在基因和蛋白质上会存在差异。
CAR-T药物往往是针对某一特定肿瘤特征进行改造的,它们不能对其他亚群的肿瘤细胞起作用。而且,不同亚群的肿瘤细胞聚在一起,形成了一个高度复杂且封闭的肿瘤微环境。在这个微环境中,外围有多种抑制性免疫信号,这使得CAR-T难以深入“敌军阵营”,也就是所谓的归巢障碍。
鉴于CAR-T细胞在穿透肿瘤微环境方面面临的挑战,TIL疗法显示出在实体瘤治疗上的潜力。当然,将适应症扩展到实体瘤,已成为CAR-T药物研究者们不断追求的目标,而TIL疗法在这方面已经取得了积极的进展。

TIL疗法
1. 发现过程
TILs的发现要追溯到1986年,那时Steven Rosenberg,也就是后来的细胞免疫之父,在一位晚期黑色素瘤患者的肿瘤组织中意外发现,许多肿瘤细胞里面竟然仍有部分免疫细胞在“冲锋陷阵”。
之后的研究揭示了这些细胞的独特之处,它们能够天然地靶向多种抗原,具备识别肿瘤特异性抗原的能力。更重要的是,它们具有CAR-T所不具备的归巢能力,即能迅速找到并抵达目标肿瘤细胞。这些免疫细胞就被称之为TILs,也就是肿瘤浸润淋巴细胞。我们需要注意的是,它是一组细胞,而不单指一种细胞。
可以说,TIL疗法解决了CAR-T乃至其他细胞疗法难以彻底解决的实体瘤难题。以“没有特定靶点”的手段回应“缺乏靶点”的问题,以“来自肿瘤微环境”克服“肿瘤微环境限制”。
怎么理解呢?
CAR-T简单来讲就是将血液中的T细胞抽出,用CAR进行工程改造让它们可以识别到肿瘤细胞,但如果肿瘤细胞又一次伪装,失去靶标,那便又产生免疫逃逸。但TILs不同,它里面有各种免疫细胞,可以靶向一系列抗原。虽然目前我们还不知道它具体靶向哪些,但打破了传统的药物研发强调靶点的思维模式。
2. 治疗流程
那既然它这么厉害,为什么不能直接消灭肿瘤呢?
还是敌军太过强大。
在肿瘤微环境的复杂影响下,TILs的数量很少,孤军奋战下难以扩增,不能发挥最大威力,所以这时候就需要人为来进行干涉了,也就是TIL疗法。
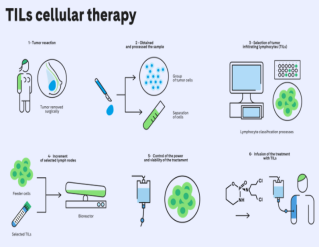
既然发现了这些猛将,怎么帮它们呢?首先,得找到它们的藏身之处,采取组织切除、穿刺活检等方式取得患者的肿瘤组织;然后,抓到它们本尊,在肿瘤组织里面分离出TILs;光有他们还不够,不足以对抗肿瘤细胞大军,得让他们叫上自己的兄弟姐妹也组成一支军队,也就是在GMP生产车间用IL-2或细胞因子等激活,扩大培养;有了军队,那就该上阵了,在患者身体状况合适情况下接受TIL回输治疗。这就是整个大致的疗程。
听起来整个流程似乎很顺利,但从Steven Rosenberg发现TILs,到全球首个TIL疗法产品上市,人类历经了近40年的探索。直到2024年2月16日,lOVANCE公司的Amtagvi获批上市,才标志着TIL疗法在商业化道路上迈出了重要的一步。
可以看出,多个因素共同导致了TIL疗法在现阶段的局限性。这不仅是由于其机理的复杂性,还因为生产体系的难度增加,同时在监管层面也面临着诸多挑战。
3. 局限性
要采取TIL疗法,首先需要满足的条件是患者的肿瘤是可以切除的。若肿瘤已经发展到无法手术切除的阶段,TIL疗法便不适用。此外,在切除肿瘤组织的过程中,必须获得足量的TIL活性样本。之后细胞还需要经历大约34天(目前IOVANS新一代的生产工艺是22天)的制备流程。
值得注意的是,这个过程不像CAR-T一样是一个标准品,它没有明确的靶细胞。由于每个患者的情况不同,肿瘤内的突变组合也各不相同。因此,从肿瘤中提取的TILs也具有个体差异。这就需要对肿瘤的成分进行针对性的分析,确保疗法的有效性。换句话说,TIL疗法是一种高度定制化的治疗方案。
正因如此,在成本方面,TIL疗法需要承受一定压力。直观来看,Amtagvi已经成为目前最昂贵的癌症免疫疗法,其费用折合人民币约370万,这还不包括IL-2的费用,一次剂量的IL-2费用高达5855美元。
另一方面,在接受TIL疗法之前,患者需要进行清淋预处理,这是一种非清髓性的淋巴清除过程。这是绝大部分的免疫细胞疗法在输注前都需要进行的一个操作。与血液瘤相比,实体瘤的清淋方案强度通常更高,这是因为实体瘤的治疗需要更有效的免疫细胞激活和扩增。
这个很好理解,人体内的淋巴细胞数量是有上限的。为了给注入的TILs腾出生存空间,我们就需要把体内现存的淋巴细胞杀掉。同时,我们的身体也很聪明,这时候会有机体反馈机制分泌细胞因子,从而促进淋巴细胞恢复,这有助于增强TIL的活性。
此外,患者还需要注射IL-2来进一步刺激TILs活性,重建免疫系统。然而,大剂量的IL-2具有一定的生物毒性,可能会产生全身毒性副作用。所以,很多晚期患者的身体条件已经不足以支撑高强度的清淋化疗和IL-2注射。也就是说,短时间内TIL疗法还不能惠及大范围患者。
4. 竞争格局
虽然很困难,但随着全球首款TIL疗法的获批上市,其商业化路径已经得到初步验证和成功。让我们来详细了解这款开创性的细胞疗法。根据FDA公布的数据,在接受推荐剂量的73名患者中,有31.5%的患者达到了客观缓解,即肿瘤体积至少缩小了30%。其中,有4.1%的患者达到了完全缓解,肿瘤完全消失;27.4%的患者达到部分缓解,肿瘤体积缩小30%以上。在达到缓解的患者中,有43.5%的患者在12个月后仍然没有出现肿瘤进展或死亡。
仅从数字看,30%+的有效率似乎并不高,但是在没有太多有效治疗方法的黑色素瘤领域就不同了。在此之前,一线主流单药治疗的总体缓解率只有20%左右。更何况,很多受试者是经过三线以上治疗的晚期患者,肿瘤已多处转移,通常预期生存期仅为七八个月,这一疗效尤其值得关注。事实上,在lOVANCE公司去年公布的研究结果中,有患者的治疗效果已经持续了4年多(59.9个月),这为晚期黑色素瘤患者带来了新的希望。
虽然Amtagvi售价高企,但其市场反响依然积极。2月29日,lOVANCE高调宣布:在获批12天的时间里,Amtagvi已经吸引了20名患者,在医院方,现在已有大约30家ATC完成了批准前的入院步骤。
再来看看国内,目前至少有14家药企正在积极开发实体瘤的TIL疗法。在这些企业中,砂砾生物目前处于领先地位,已经成功进入二期临床试验阶段,预计到2025年底可以完成临床试验并申报上市,有望成为国内首个获批的TIL疗法。
在全球范围内推进较快的中国企业百吉生物,也在快速推进其TIL疗法的研发,特别是其全球首创的肝癌TIL疗法,不必再使用高剂量的IL-2,这可能会降低治疗的副作用和成本。
此外,卡替医疗也在研发一种创新的类TIL细胞疗法,其特点是无需手术,且制备时间可以大幅压缩至2天。这种疗法的开发,显示了TIL疗法在制备流程和应用范围上的新突破。同时,还有其他公司如君赛生物、天科雅生物等也在紧锣密鼓地推进TIL疗法的研发。

就普及率来讲,TIL疗法还存在一定挑战。最直接的挑战是高昂的治疗成本,这给患者带来了极大的压力。况且在生产工艺、技术水平上的限制也使得目前只有一小部分符合条件的患者能够接受这种治疗。
然而,就市场来看,TIL疗法具有较好的前景。根据全球肿瘤发病情况,血液瘤相对较少,而发病率最高的十大实体瘤就占到年新发癌症患者的78%,包括肺癌、胃癌、肠癌、乳腺癌等。从这个角度来看,细胞疗法“杀入”实体瘤领域,才真正意味着打开了千亿美元肿瘤治疗市场的大门。


本文作者可以追加内容哦 !

