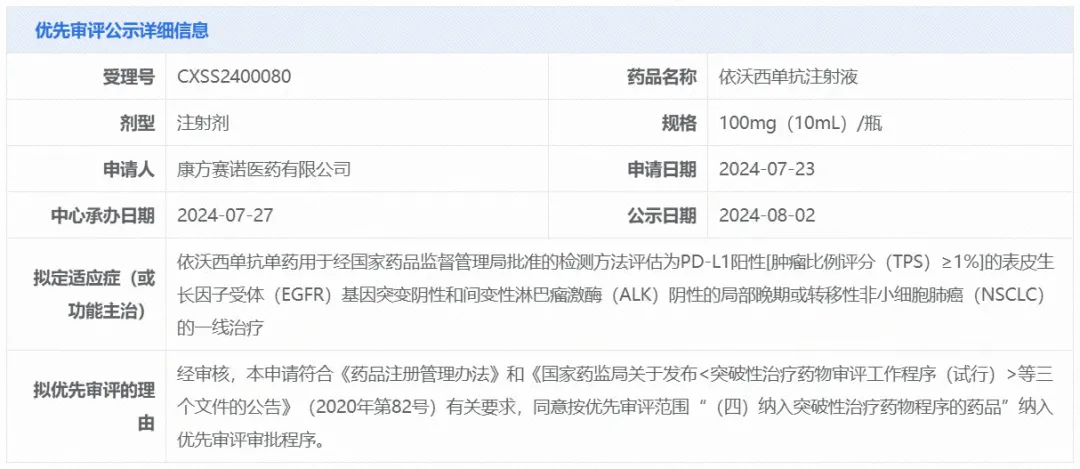
今日(8月2日),中国国家药监局(NMPA)药品审评中心(CDE)最新公示,康方生物的依沃西单抗注射液的新适应症上市申请拟纳入优先审评,适应症为:单药用于经NMPA批准的检测方法评估为PD-L1阳性[肿瘤比例评分(TPS)≥1%]的表皮生长因子受体(EGFR)基因突变阴性和间变性淋巴瘤激酶(ALK)阴性的局部晚期或转移性非小细胞肺癌(NSCLC)的一线治疗。就在几日前,该上市申请刚刚获得了CDE的受理。
图片来源:CDE官网截图
依沃西单抗注射液是一种靶向结合人血管内皮生长因子-A(VEGF-A)和PD-1的IgG1亚型人源化双特异性抗体。今年5月,依沃西单抗注射液在中国已经获批用于特定的非鳞状非小细胞肺癌(NSCLC)患者治疗。康方生物指出,依沃西是全球第一个获批上市的“肿瘤免疫+抗血管生成”机制的双特异性抗体新药。
不久前备受行业瞩目的一项进展在于,依沃西单药对比对照药物一线治疗PD-L1表达阳性(PD-L1 TPS≥1%)的局部晚期或转移性非小细胞肺癌(NSCLC)的注册性3期临床研究期中分析达到主要研究终点,取得了决定性阳性结果。此次依沃西新适应症上市申请正是基于这项HARMONi-2研究。该研究的期中分析已取得强阳性结果:在意向治疗人群(ITT)中,依沃西单抗单药相较于对照药物单药显著延长了患者无进展生存期(PFS),风险比(HR)显著优于预期。
康方生物创始人、董事长、总裁兼首席执行官夏瑜博士对此表示,依沃西在HARMONi-2研究中展现了优异的疗效和安全性,进一步夯实了依沃西作为肿瘤免疫治疗(IO)基石产品的巨大潜力,包括与ADC药物或其它新型抗癌药物联用的广阔临床开发价值和市场前景。

根据康方生物资料,该公司已经开展多项针对依沃西单药或与化疗联合疗法治疗实体瘤的临床研究,涵盖肺癌、三阴性乳腺癌、头颈部鳞癌、结直肠癌等16个适应症的20多项临床研究。在全球范围内,依沃西共有6项3期临床研究正在进行中。
依沃西单抗的潜力也被国际公司所看好。康方生物曾于2022年12月以5亿美元首付款、总交易额高达50亿美元和销售净额低双位数比例提成的合作方案,授予Summit Therapeutics于美国、加拿大、欧洲和日本对依沃西单抗的开发和商业化独家许可权。2024年6月,双方签署补充许可协议,在原有合作协议下拓展依沃西的许可市场范围,加速依沃西在全球各地区的监管注册及商业化。Summit将新增获得依沃西在中美、南美、中东和非洲等相关市场的开发及商业化独家权益。康方生物将获得7000万美元的首付款和里程碑款,以及依沃西在新增许可市场的销售提成。
$恒生医疗ETF(SH513060)$$康方生物(HK|09926)$$复星医药(SH600196)$#创新药利好不断,如何把握投资机会?#
来源:医药观澜
免责声明:转载内容仅供读者参考,版权归原作者所有,内容为作者个人观点,不代表其任职机构立场及任何产品的投资策略。本文只提供参考并不构成任何投资及应用建议。如您认为本文对您的知识产权造成了侵害,请立即告知,我们将在第一时间处理。
本文作者可以追加内容哦 !

