
一、本周国内及全球各项资产价格表现
本周,上证指数涨0.5%,收2905;深成指跌0.51%,收8553;创业板指数跌1.28%,收1638。恒生指数跌0.45%,国企指数跌0.6%,恒生科技指数跌1.69%;道琼斯工业指数跌2.1%,纳斯达克跌3.35%,标普500跌2.06%。大宗商品大幅波动,布伦特原油期货跌5.32%,LME铜跌0.26%,COMEX黄金涨4.41%,离岸人民币单周跌1.36%,收报7.1651,美元指数跌1.06。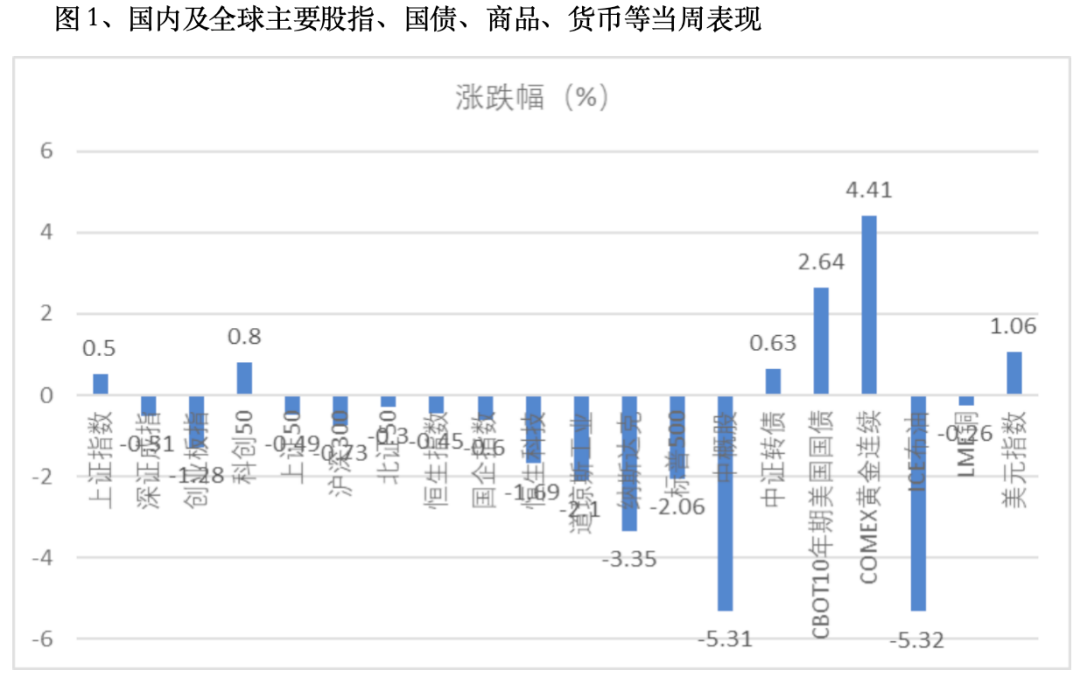
二、A股市场动态观点更新
两会后,各部门密集发布三中全会改革文件,市场信心恢复,成交量逐步放大,资金活跃,连续涨停、涨停个股数量都比前阶段增多,略有赚钱效应。高股息股票回调,吸金效应减弱,其他类股票迎来反弹契机。尽管三大指数相对较弱,但行业板块涨多跌少,个股中位数表现优于指数。上海出台《关于支持生物医药产业全链条创新发展的若干意见》,推出八方面37条政策举措;国务院办公厅印发《关于健全基本医疗保险参保长效机制的指导意见》。随着医药政策密集出台,生物医药板块大幅反弹。三中全会把教育提升到新的高度,明确教育、科技、人才是中国式现代化的基础性、战略性支撑。有数据显示:国内目前增长最快、发展最好的行业是教培,尤其是学科类教培。教育相关板块,本周涨幅。谷歌、微软、苹果、亚马逊等大型科技股的业绩表现低于预期,冷却了人们对AI的乐观情绪,前期涨幅较大的AI相关板块波动加大,回调较大。A股AI相关概念、芯片、半导体全线下挫。从行业板块看,申万一级行业31个板块,上涨23个,下跌8个。社会服务、建筑装饰、医药生物涨幅居前,分别涨5.49%、3.27%、3.21%。煤炭、公用事业、电力设备跌幅居前,分别跌1.63%、1.75%、2.04%。资金面:国内为了维持下半年经济预期目标,已经开始降低存贷款利息。美国经济下行态势的延续、通胀压力的放缓以及就业压力的持续体现,9月份大概率降息,美国靠高利率吸引资金回流,然后带动股市相关资本上涨的循环将会打破,美元资产利差套利消失,甚至负收益。资金将会回流到受压的其他市场。国内资产最近两年正好和美国交易相反,资金会有部分回流,边际改善A股资金压力。股市流动性:A股日成交量开始回暖,从6000多亿回升,最高到9000亿。外围市场大幅波动,资金有回流迹象,北上资金全周净买入32亿。本周融资略有加仓;基金赎回压力依然存在。二季度GDP增长只有4.7%,为了保证下半年5%的GDP增长目标,后续会加大宏观调控力度,加强逆周期调节,并有更多刺激经济政策落实。一定程度缓解经济增长压力,扭转流动性和悲观情绪,市场风险偏好和信心将会回暖。如果美国9月降息,国内资金外流压力减轻,宏观政策回旋余地更加灵活,为经济发展和资本市场活跃提供有利环境。现阶段看空A股不合时宜,市场可能走出调整的节奏。但现在交易量依然较小,难以拉动大多数股票上涨,结构性机会优于大盘指数。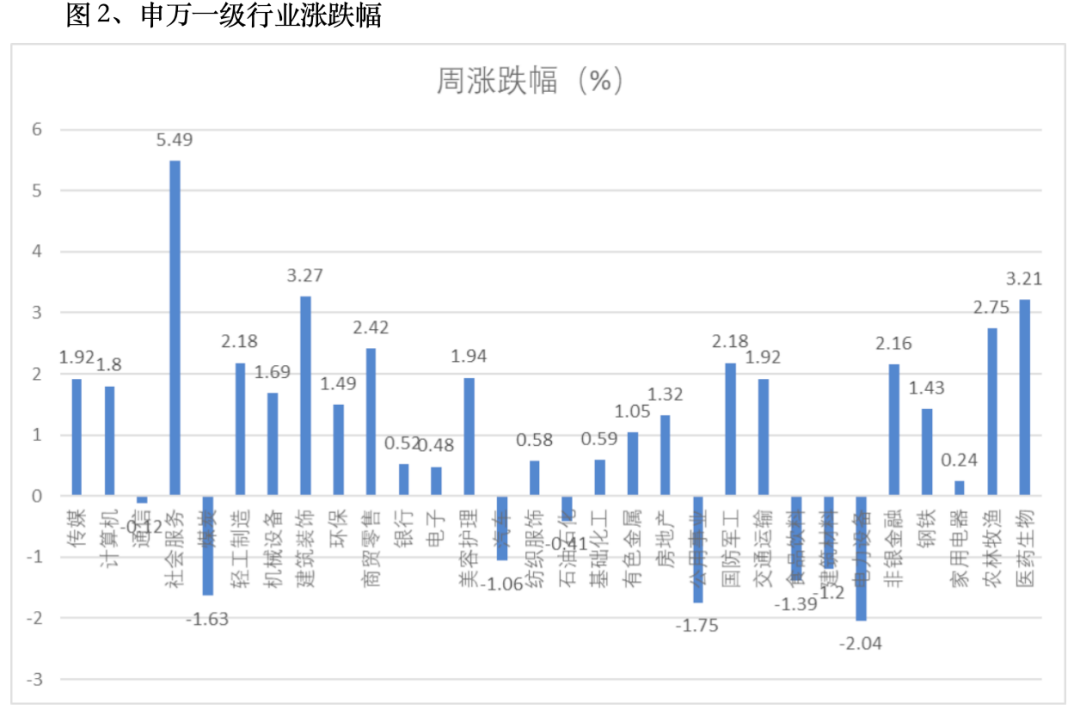
三、ADC药物:肿瘤治疗的新一代技术革命
随着技术的进步,更新迭代的ADC药物通过优化各种因素,尤其是加入旁观者效应,在疾病管理中显示出更强的效能。在肿瘤治疗过程中,ADC药物最终可能会取代经典化疗方法。 许多传统的化疗药物对肿瘤细胞具有强大的杀伤作用,但是这些化疗药物不仅能够杀伤肿瘤细胞,也无差别的攻击人类正常细胞。有选择性、只杀伤癌细胞的靶向药物一直是医药界追寻的长期目标。抗体偶联药物(ADC)是由靶向特异性抗原的单克隆抗体与小分子细胞毒性药物通过连接子链接而成,兼具传统小分子化疗的强大杀伤效应及抗体药物的肿瘤靶向性。ADC药物由三个主要部分组成:负责选择性识别癌细胞表面抗原的抗体,负责杀死癌细胞的药物有效载荷,以及连接抗体和有效载荷的连接子。 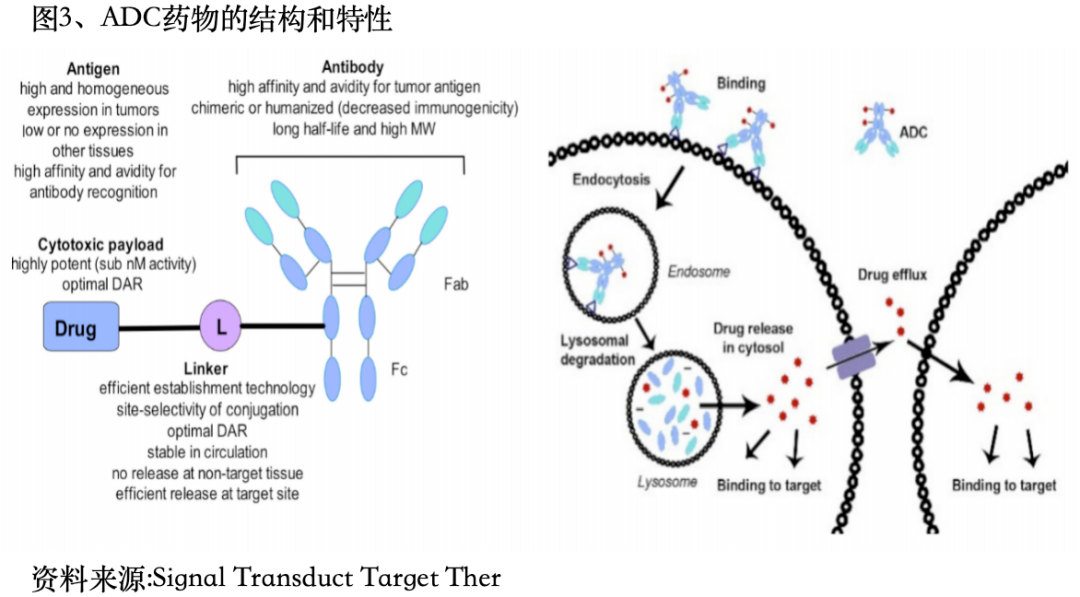
ADC药物的作用机制
通常包括以下几个步骤:抗体与癌细胞表面的特定抗原结合。抗体与抗原结合后,通过内吞作用将ADC药物带入肿瘤细胞内部。抗原-抗体-药物复合物被递送到溶酶体腔室。在细胞内部,连接子被特定的酶切割,释放出有效载荷。释放的细胞毒性药物杀死癌细胞。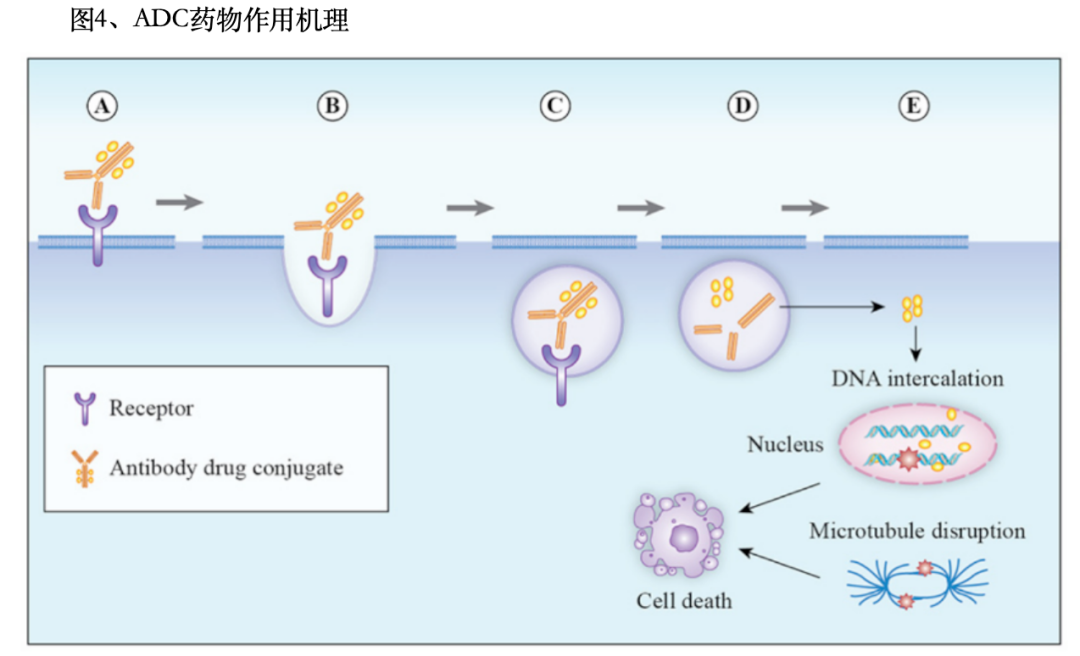
ADC药物发展历史
第一阶段(1906-1982年)靶向治疗概念被提出,技术雏形;
第二阶段(1983-2011年)临床商业化过渡,2000年FDA批准首款ADC药物吉妥珠单抗;
第三阶段(2012-至今)ADC产品爆发式增长,目前全球共有15种ADC药物获批用于血液系统恶性肿瘤和实体瘤。目前,超过400种ADC候选药物正处于临床试验的不同阶段。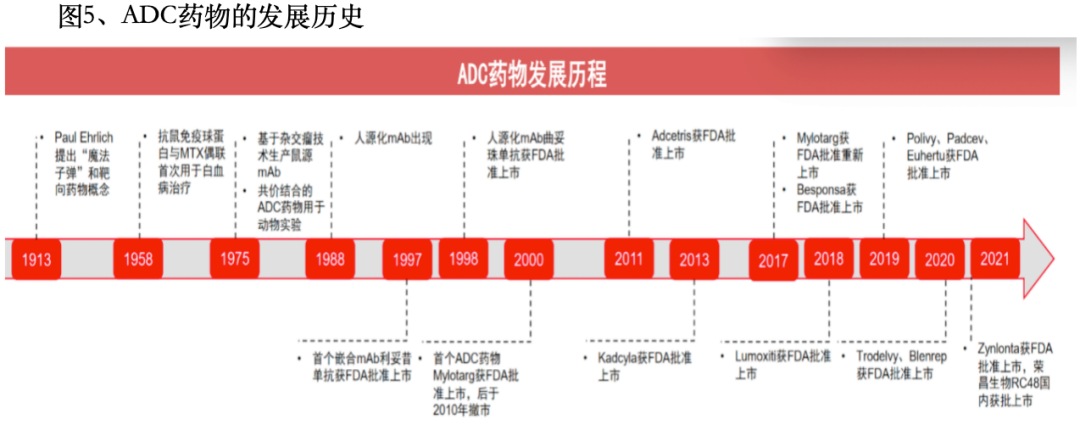 ADC药物技术迭代 ADC药物发展至今共经历了三代技术变革,在payload、抗体修饰以及偶联技术方面均有所突破,而最新的第三代ADC药物朝安全性、稳定性方向发展,最为突出的特点就是实现了定点偶联。(1)第一代ADC药物代表药物:第一代ADC代表药物是Mylotarg,因严重致命肝损伤且无明显生存获益,于2010年自愿退出市场,并于2017年重新上市。主要特点是:1)连接子不稳定:导致毒性有效载荷不受控制地释放和意想不到的脱靶毒性;2)毒素容易聚集:有效载荷疏水性强,容易引起抗体聚集,清除速度快、半衰期短和免疫原性高;3)药物的异质性:基于赖氨酸残基的随机偶联,产生DAR不同的高度异质混合物。 (2)第二代ADC药物第二代ADC药物在一代的基础上进行了优化,使用了活性更高的细胞毒药物,并随单抗技术的发展提高了对肿瘤部位的靶向特异性,新的连接子及偶联策略的开发提高了ADC药物的偶联效率、整体的水溶性以及在血浆中的稳定性。目前上市的ADC药物大多属于第二代范畴。第二代ADC药物具有更好的临床疗效和安全性,但也仍有不足之处,如脱靶毒性导致的治疗窗口不足,传统非定点偶联方式导致的分布均一性差、存在未结合抗体以及高药物抗体比值(DAR)ADC的聚集或快速清除。主要特点是:1)使用IgG1全人源化抗体,更适合具有小分子有效载荷和高癌细胞靶向能力的生物偶联;2)采用毒性更高的有效载荷,提高了水溶性和偶联效率。可以将更多有效负载分子加载到每个抗体上,而不会诱导抗体聚集;3)连接子的改进实现了更好的血浆稳定性和更均一的DAR分布。 (3)第三代ADC药物第三代ADC药物的主要革新在于偶联方式的改变,采用定点偶联技术制备的DAR为2或4的ADC药物具有更佳的一致性,表现出更低的脱靶毒性和更好的药代动力学效率。此外,更高效细胞毒药物,如吡咯并苯并二氮杂(PBD)、杜卡霉素等的使用、连接子类型的拓展也进一步提高了ADC药物的稳定性和抗癌活性。目前大量新型ADC药物正在临床研究中,通过对抗体、细胞毒药物、连接子及偶联方式等方面的不断优化,提升ADC的整体性能。第三代ADC具有更低的毒性反应、更高的抗肿瘤活性以及更高的稳定性,其特点如下:1)均一DAR,显示出更少的脱靶毒性,治疗窗增大;2)采用全人源化抗体而非嵌合抗体以降低免疫原性;3)开发使用更有效的载荷:PBD和具有新机制的免疫调节剂;4)采用了更多的亲水性连接子组合(多肽类)。
ADC药物技术迭代 ADC药物发展至今共经历了三代技术变革,在payload、抗体修饰以及偶联技术方面均有所突破,而最新的第三代ADC药物朝安全性、稳定性方向发展,最为突出的特点就是实现了定点偶联。(1)第一代ADC药物代表药物:第一代ADC代表药物是Mylotarg,因严重致命肝损伤且无明显生存获益,于2010年自愿退出市场,并于2017年重新上市。主要特点是:1)连接子不稳定:导致毒性有效载荷不受控制地释放和意想不到的脱靶毒性;2)毒素容易聚集:有效载荷疏水性强,容易引起抗体聚集,清除速度快、半衰期短和免疫原性高;3)药物的异质性:基于赖氨酸残基的随机偶联,产生DAR不同的高度异质混合物。 (2)第二代ADC药物第二代ADC药物在一代的基础上进行了优化,使用了活性更高的细胞毒药物,并随单抗技术的发展提高了对肿瘤部位的靶向特异性,新的连接子及偶联策略的开发提高了ADC药物的偶联效率、整体的水溶性以及在血浆中的稳定性。目前上市的ADC药物大多属于第二代范畴。第二代ADC药物具有更好的临床疗效和安全性,但也仍有不足之处,如脱靶毒性导致的治疗窗口不足,传统非定点偶联方式导致的分布均一性差、存在未结合抗体以及高药物抗体比值(DAR)ADC的聚集或快速清除。主要特点是:1)使用IgG1全人源化抗体,更适合具有小分子有效载荷和高癌细胞靶向能力的生物偶联;2)采用毒性更高的有效载荷,提高了水溶性和偶联效率。可以将更多有效负载分子加载到每个抗体上,而不会诱导抗体聚集;3)连接子的改进实现了更好的血浆稳定性和更均一的DAR分布。 (3)第三代ADC药物第三代ADC药物的主要革新在于偶联方式的改变,采用定点偶联技术制备的DAR为2或4的ADC药物具有更佳的一致性,表现出更低的脱靶毒性和更好的药代动力学效率。此外,更高效细胞毒药物,如吡咯并苯并二氮杂(PBD)、杜卡霉素等的使用、连接子类型的拓展也进一步提高了ADC药物的稳定性和抗癌活性。目前大量新型ADC药物正在临床研究中,通过对抗体、细胞毒药物、连接子及偶联方式等方面的不断优化,提升ADC的整体性能。第三代ADC具有更低的毒性反应、更高的抗肿瘤活性以及更高的稳定性,其特点如下:1)均一DAR,显示出更少的脱靶毒性,治疗窗增大;2)采用全人源化抗体而非嵌合抗体以降低免疫原性;3)开发使用更有效的载荷:PBD和具有新机制的免疫调节剂;4)采用了更多的亲水性连接子组合(多肽类)。 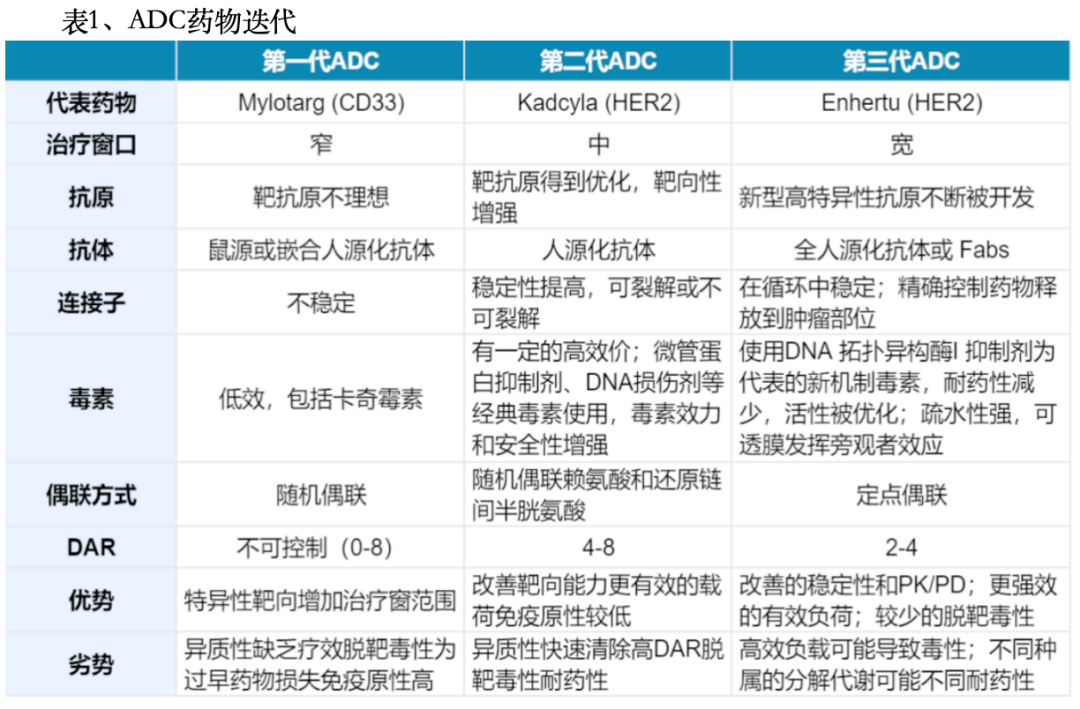
ADC药物市场空间
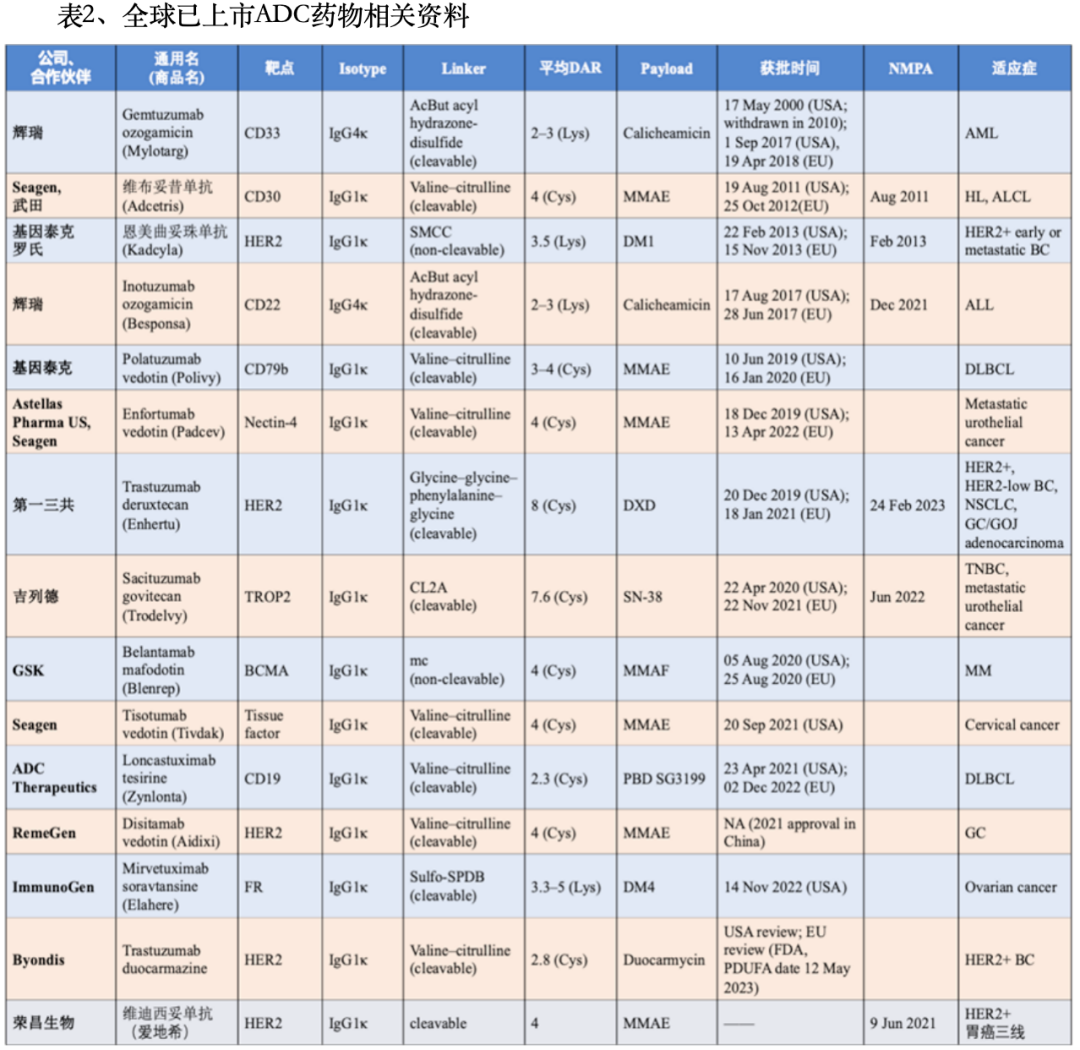
目前全球ADC药物共获批15款药物,其中我国获批的ADC类药物有6款,分别是恩美曲妥珠单抗、维布妥昔单抗、奥加伊妥珠单抗、维迪西妥单抗、戈沙妥珠单抗、德曲妥珠单抗。根据弗若斯特沙利文的数据,全球ADC药物市场规模预计将从2022年的79亿美元增长至2030年的647亿美元,2017年至2022年年均复合增长率37.3%,2022年至2030年年均复合增长率30.0%。ADC药物在整体生物制剂市场中的份额预计将由2022年的2.2%增长至2030年的8.3%。
ADC药物核心结构
一个成功的ADC药物取决于两个关键因素。第一需要一个稳定可靠的连接子连接抗体和有效载荷。第二个成功的关键因素是必须将一种强大的细胞毒性剂偶联到抗体上。在构建ADC时需要综合考虑五大核心要素:靶点、抗体、连接子、载荷和偶联方式。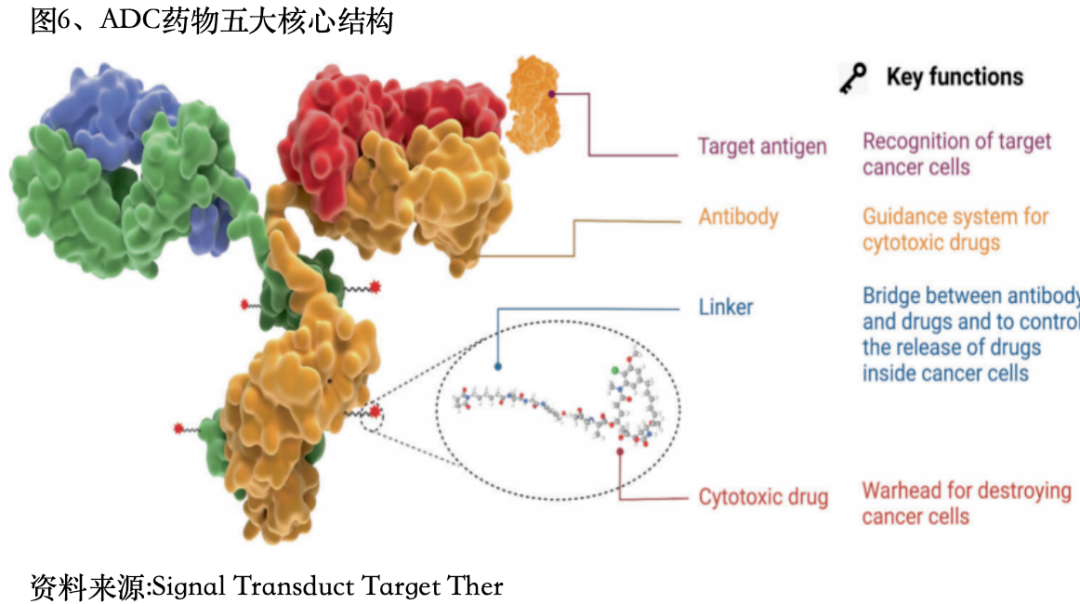 1)靶点ADC药物制备起点是靶点选择,药物安全性和有效性主要依赖于靶抗原的选择,及与其相互作用。理想的靶点应具备以下特性:靶抗原在肿瘤细胞中的表达水平显著高于正常细胞,或在正常细胞中几乎不表达或表达水平极低。目标抗原应主要分布在肿瘤细胞的细胞膜表面,以便特异性抗体能够准确识别并与之结合。抗原的稳定性是关键,它不应轻易从肿瘤细胞表面脱落,以避免与循环中的抗体发生非特异性结合。目标抗原应具备内化能力,这是ADC药物有效性的一个重要因素。ADC药物的热门靶点有HER2、Trop2、EGFR、c-Met、B7-H3、HER3、Nectin-4、CLDN18.2、PDL1等多个成熟的靶点。(2)抗体抗体作为ADC药物的精确制导部件,具有靶向定位及毒素运载的功能。可以特异性识别肿瘤细胞表面的靶抗原,将毒素带到肿瘤细胞,介导着ADC在肿瘤细胞的定位与内吞。在ADC药物开发的早期阶段,主要使用鼠源性抗体,由于严重的免疫原性副作用,失败率高。随着重组技术的出现,鼠源性抗体大多被嵌合抗体和人源化抗体所取代。在目前全球14种已获批的ADC药物中,只有brentuximab vedotin使用嵌合抗体。理想的抗体还应具备低免疫原性、较长的体内半衰期、促进肿瘤细胞内化的能力,以及在血液循环中的高稳定性。目前市场上批准的ADC产品主要采用免疫球蛋白G类别的抗体,具体亚型包括IgG1、IgG2、IgG3和IgG4。(3)连接子连接子需要承担两个任务:首先,它要保证ADC在血液中有较好的稳定性;其次,它要保证ADC能精准地将载荷在目标位置释放。连接子的性质对ADC的多个关键参数有着显著影响,包括药物-抗体比值(DAR)、有效载荷的释放动力学、治疗窗口以及药代动力学和药效学特性。第三代ADC药物多采用肽连接子,可在细胞内溶酶体的酶催化下迅速裂解,不会轻易断裂,进入肿瘤细胞内才发生断裂释放药物。提高药物抗体比值(DAR)的均一性。连接子分为两类:不可切割型和可切割型。可切割连接子进一步细分为化学切割连接子和酶切割连接子。不可切割连接子作为抗体分解产物中的氨基酸残基连接,在体内一般化学和酶环境中表现出低活性,确保高血浆稳定性。
1)靶点ADC药物制备起点是靶点选择,药物安全性和有效性主要依赖于靶抗原的选择,及与其相互作用。理想的靶点应具备以下特性:靶抗原在肿瘤细胞中的表达水平显著高于正常细胞,或在正常细胞中几乎不表达或表达水平极低。目标抗原应主要分布在肿瘤细胞的细胞膜表面,以便特异性抗体能够准确识别并与之结合。抗原的稳定性是关键,它不应轻易从肿瘤细胞表面脱落,以避免与循环中的抗体发生非特异性结合。目标抗原应具备内化能力,这是ADC药物有效性的一个重要因素。ADC药物的热门靶点有HER2、Trop2、EGFR、c-Met、B7-H3、HER3、Nectin-4、CLDN18.2、PDL1等多个成熟的靶点。(2)抗体抗体作为ADC药物的精确制导部件,具有靶向定位及毒素运载的功能。可以特异性识别肿瘤细胞表面的靶抗原,将毒素带到肿瘤细胞,介导着ADC在肿瘤细胞的定位与内吞。在ADC药物开发的早期阶段,主要使用鼠源性抗体,由于严重的免疫原性副作用,失败率高。随着重组技术的出现,鼠源性抗体大多被嵌合抗体和人源化抗体所取代。在目前全球14种已获批的ADC药物中,只有brentuximab vedotin使用嵌合抗体。理想的抗体还应具备低免疫原性、较长的体内半衰期、促进肿瘤细胞内化的能力,以及在血液循环中的高稳定性。目前市场上批准的ADC产品主要采用免疫球蛋白G类别的抗体,具体亚型包括IgG1、IgG2、IgG3和IgG4。(3)连接子连接子需要承担两个任务:首先,它要保证ADC在血液中有较好的稳定性;其次,它要保证ADC能精准地将载荷在目标位置释放。连接子的性质对ADC的多个关键参数有着显著影响,包括药物-抗体比值(DAR)、有效载荷的释放动力学、治疗窗口以及药代动力学和药效学特性。第三代ADC药物多采用肽连接子,可在细胞内溶酶体的酶催化下迅速裂解,不会轻易断裂,进入肿瘤细胞内才发生断裂释放药物。提高药物抗体比值(DAR)的均一性。连接子分为两类:不可切割型和可切割型。可切割连接子进一步细分为化学切割连接子和酶切割连接子。不可切割连接子作为抗体分解产物中的氨基酸残基连接,在体内一般化学和酶环境中表现出低活性,确保高血浆稳定性。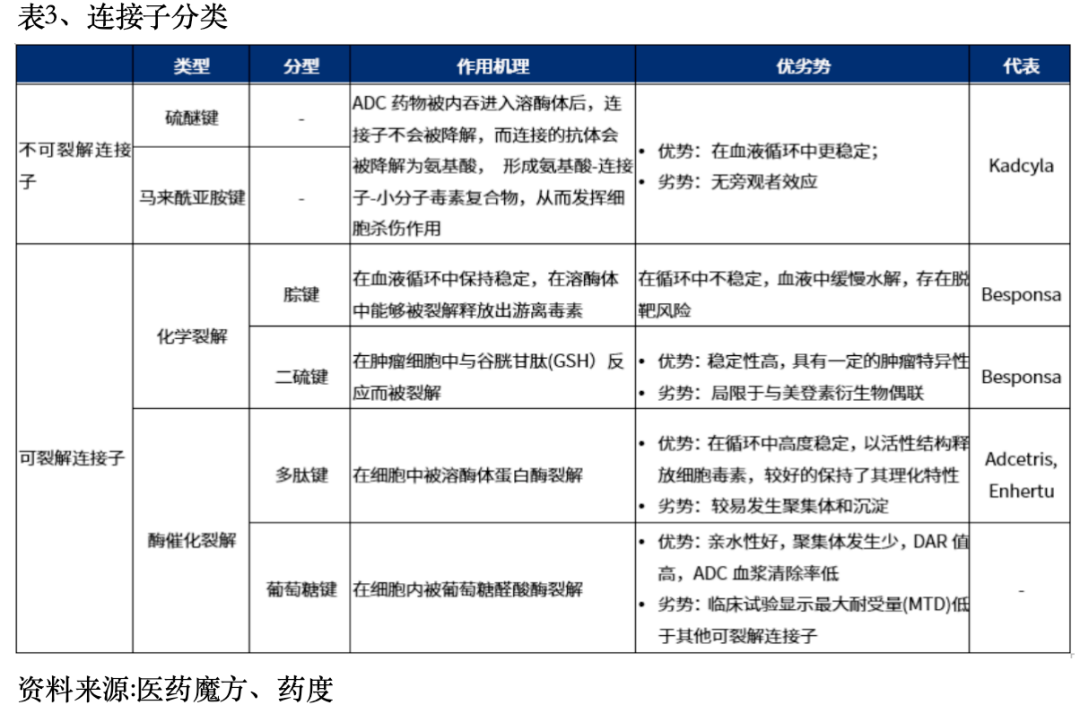
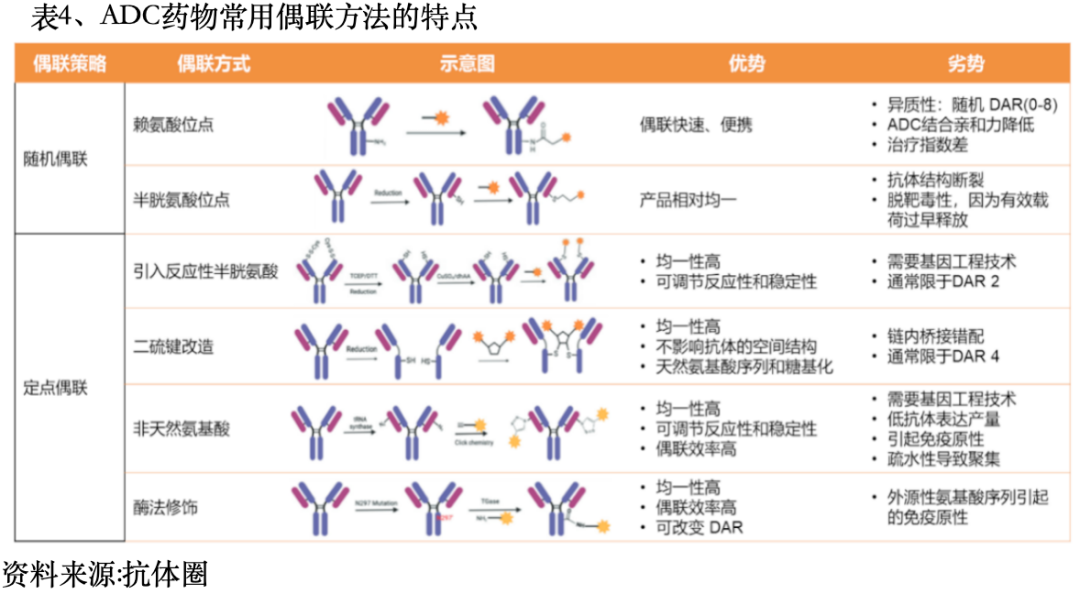
定点偶联技术:引入反应性半胱氨酸偶联(Thio-mab)技术、链间二硫键改造、非天然氨基酸偶联技术、酶法修饰偶联等。
特别提示:以上内容中所涉及的产品/服务信息仅供投资者参考,不构成任何投资建议,投资者应自主决策,并根据自身风险能力和风险偏好选择合适的投资品种,本公司不对投资者的投资决策做任何保证 ,亦不承担任何责任,投资者需自主独立承担相关风险。投资有风险,入市需谨慎。

追加内容
本文作者可以追加内容哦 !

