2024年8月2日
医麦客新闻 eMedClub News
Adaptimmune宣布其TCR-T细胞疗法Afami-cel已经获得美国FDA批准上市,用于治疗晚期滑膜肉瘤。值得一提的是,这是全球首款获批上市的TCR-T细胞疗法,具有重大里程碑意义,给晚期滑膜肉瘤患者带来“变革性”治疗手段的同时,也填补了TCR-T赛道的空白,提振了行业信心。
Afami-cel申报BLA并获批上市是基于关键试验SPEARHEAD-1的临床数据:转移性或不可切除滑膜肉瘤患者的总体缓解率(ORR)为39%,中位缓解持续时间约为12个月。以往接受过两种或两种以上疗法的滑膜肉瘤患者的中位总生存期(OS)小于12个月,而接受Afami-cel治疗患者的中位OS约为17个月,优于历史对照数据。在接受Afami-cel治疗两年后,70%的反应者仍然存活。
在Afami-cel获批之前,Adaptimmune就已经在为afami-cel的商业上市做准备,其授权的治疗中心已经从最初的6-10个扩展到30+个,并且,100%面向商业和医疗事务团队的客户已经到位。Adaptimmune的首席执行官Adrian Rawcliffe认为,美国每年约有400名患者有资格接受Afami-cel治疗,他对该公司维持供应的能力充满信心,直到细胞疗法的“销售高峰”。
另外,继Afami-cel获批之后,Adaptimmune计划在2026年推出用于滑膜肉瘤和黏液样圆细胞脂肪肉瘤(MRCLS)的lete-cel,这是一款靶向NY-ESO-1的TCR-T细胞疗法,目前处于2期临床试验阶段。此前,lete-cel的一项临床研究数据显示,73例接受Lete-cel治疗的患者中有45例可评价,其中ORR达到40%,2例CR,16例PR。值得一提的是,据预测,Afami-cel和lete-cel的峰值销售额将可能达到4亿美元。
国内TCR-T细胞疗法驶入快车道
全球首款TCR-T细胞疗法获批上市令行业振奋,而国内也在加速推进TCR-T细胞疗法的研发。据不完全统计,国内布局TCR-T细胞疗法的企业有17家,其中大部分都已经进入临床研究阶段。其中,香雪生命科学的TAEST16001已经进入临床2期,进展较快,其首个临床适应症晚期软组织肉瘤2期临床试验的阶段性总结数据已经于今年6月在ASCO上公布,根据RECIST1.1,由独立影像评估委员会(IRC)评估的最佳缓解率为50%(4/8)。该疗法已于近日被纳入突破性治疗品种名单。
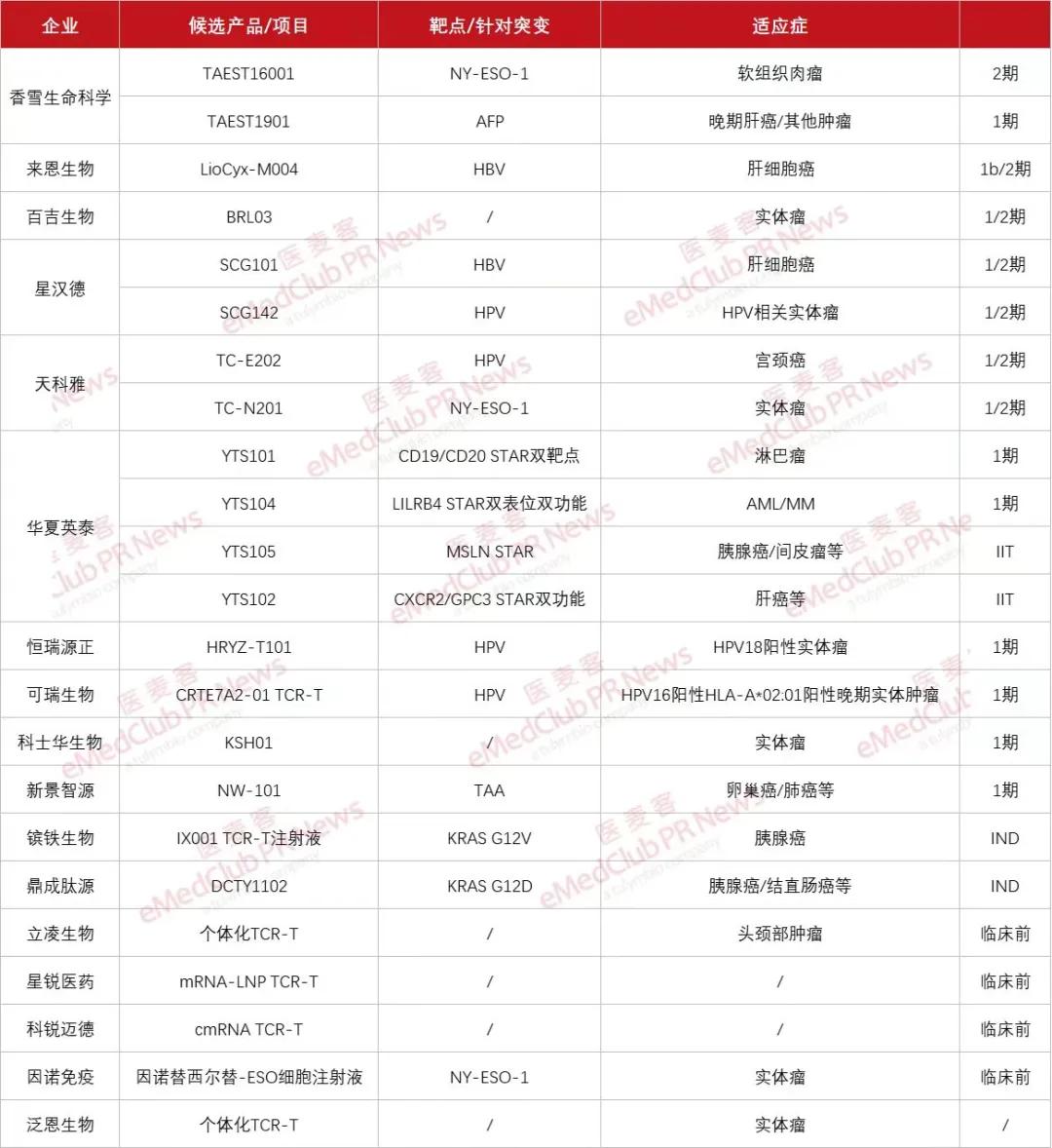
国内TCR-T企业(图片来源:医麦客整理)
在研TCR-T细胞疗法的靶点趋于多样化,其中选择HPV的入局者数量位居前列;在适应症方面,针对HPV相关肿瘤和肝癌的数量较多;在候选产品研发方面,企业采用了丰富的创新技术,包括利用mRNA技术、基因编辑技术等,有助于提升候选产品的安全性和疗效,同时也对病毒载体和非病毒载体展开了双重探索。整体而言,国内TCR-T细胞疗法正蓬勃发展,首款TCR-T细胞疗法的获批上市,也意味着监管路径已经走通,也将会带来更多商业化经验,而这也有助于国内TCR-T细胞疗法的发展。
香雪生命科学、来恩生物、百吉生物、星汉德、天科雅、华夏英泰、恒瑞源正、可瑞生物、科士华生物以及新景智源均已经进入临床研究阶段。镔铁生物的IX001 TCR-T注射液的IND申请已经于今年7月获得CDE受理,鼎成肽源的DCTY1102注射液的IND申请于今年5月获得CDE受理。
百吉生物的BRL03是第四代TCR-T细胞疗法,是基于其自主创新技术平台IDENTIFIER开发的,使得所筛选出来的TCR具有更高的亲和力和特异性,能够针对多种实体瘤。而另一个自主研发的平台MSE-T使得BRL03具有额外的功能模块组件,减少细胞耗竭以提升抗肿瘤的持久性。
目前,这款候选产品已经完成中美注册临床双报双批。值得一提的是,BRL03是百吉生物自主研发的全球首款针对肺癌和胃癌等多种实体肿瘤的TCR-T候选产品,其1期临床试验也在今年6月完成了首例受试者入组,并计划在今年年底完成所有1期受试者入组。在此前的IIT研究中, BRL03已展现出良好的安全性和初步疗效。
星汉德生物的SCG142是新一代嵌合开关受体强化的TCR-T细胞疗法,核心技术是利用星汉德生物独家拥有的GianTCRTM技术平台成功筛选分离天然高亲和力HPV特异性TCR,并与嵌合开关受体相结合,能够提升T细胞增殖能力和肿瘤抑制作用。今年7月,该候选产品在美获批1/2期临床试验。
在以病毒抗原为靶点的TCR-T细胞疗法中,来恩生物的LioCyx-M004进展位居前列,其是全球首个针对HBV抗原的TCR-T,利用mRNA编码TCR,并通过电穿孔导入T细胞中,使得LioCyx-M004更加安全可控,并支持多次回输给药。
在处于临床前研究阶段的候选产品中,星锐医药开发了肝外靶向的LNP药物递送系统能够精确实现器官递送和特定亚细胞类型递送。其“新型mRNA-LNP靶向递送技术在原位CAR-T和TCR-T疗法中的应用”已经成功入选2023年国家生物药技术创新中心细胞疗法“揭榜挂帅”技术攻关拟立项目中的“重大项目”。
科锐迈德左炽健团队联合上海交通大学医学院附属第一人民医院/上海市第一人民医院张岩与宋献民研究团队曾在Molecular Therapy上发文,首次报道了利用环状mRNA(cmRNA)制备TCR-T细胞疗法以治疗造血干细胞移植后人巨细胞病毒(CMV)感染,在电转后7天与11天,分别有约80%与50%的T细胞表达外源TCR受体。
国内各大TCR-T细胞疗法企业不仅推动了技术上的不断创新与突破,也加速了与国际市场的接轨。多家企业的在研产品不仅在国内取得了进展,还纷纷启动了国际多中心临床试验。在政策层面,国内对细胞疗法的支持力度也在不断加强。监管部门通过优化审批流程、完善法律法规等措施,为TCR-T细胞疗法的研发和未来商业化提供了更加有利的环境。同时,政府还加大了对细胞疗法产业的投资力度,鼓励企业加大研发投入,推动技术创新和产业升级。
展望未来,随着全球首款TCR-T细胞疗法的成功上市和国内企业的不断努力,全球范围内TCR-T细胞疗法领域有望迎来爆发式增长。预计在未来几年内,将有更多TCR-T细胞疗法产品获批上市,为患者提供更多样化、更精准的治疗选择。
本文作者可以追加内容哦 !

