8月5日,Biontech公布将不再参与和Genmab现有合作下acasunlimab项目的进一步开发。同时,Genmab A/S 宣布将全权负责acasunlimab的持续开发和潜在商业化,并计划在今年下半年启动3期研究。

Acasunlimab (GEN1046) 是一种在研 PD-L1x4-1BB 双特异性抗体,融合了 Genmab 专有的 DuoBody 技术平台和 BioNTech 专有的免疫调节抗体。Acasunlimab 旨在通过有条件地激活 T 细胞和自然杀伤 (NK) 细胞上的 4-1BB 来引发抗肿瘤反应,这严格依赖于 PD-L1 臂的同时结合。
目前正在对这款候选药物进行三项临床试验:
(1) 针对多种实体瘤患者的 1/2 期安全性和 PK 试验
(2) 针对日本晚期实体瘤患者的 1 期剂量递增试验
(3) 一项随机 2 期安全性和有效性试验,其中 acasunlimab 作为单药疗法和与 pembrolizumab 联合使用,用于既往使用免疫检查点抑制剂进行标准治疗失败的非小细胞肺癌 (NSCLC) 患者。
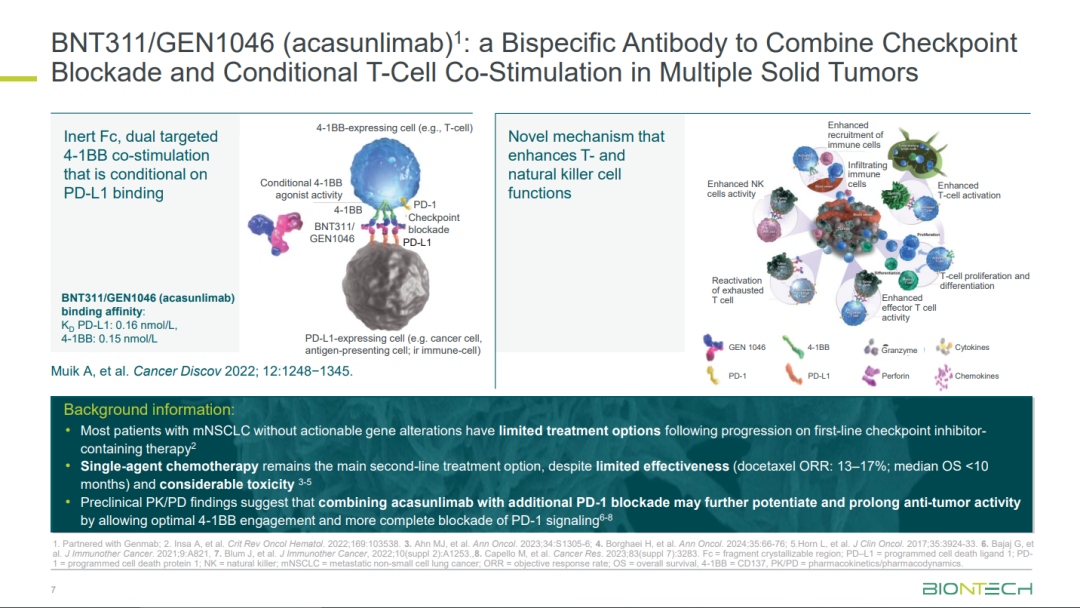
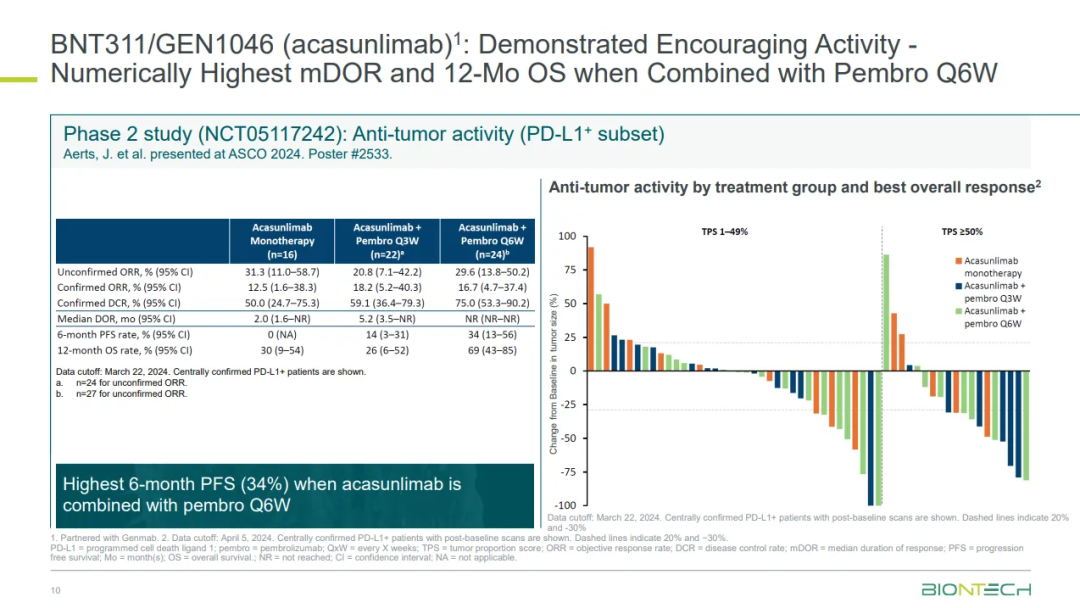
今年ASCO大会上,GEN1046在免疫检查点抑制剂进行标准治疗失败的非小细胞肺癌 (NSCLC) 患者上展现出鼓舞人心的数据:GEN1046单药确认ORR为12.6%,DCR为50.0%;GEN1046和K药联合Q3W给药组ORR为18.2%,DCR为59.1%。GEN1046和K药联合给药Q6W 6个月PFS和12个月OS分别为34%和69%!
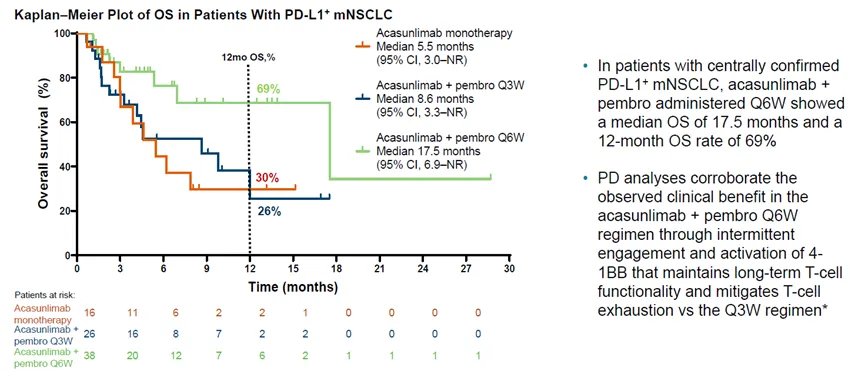
在OS方面,GEN1046和K药联合Q6W的mOS为17.5个月,而GEN1046单药和GEN1046和K药联合Q3W分别为5.5个月和8.6个月。12个月的OS三个队列分别为30%,26%和69%。总体看,Acasunlimab和PD-1单抗Pembrolizumab联合,给药方案为Acasunlimab 100mg+PD- 1 400mg Q6W队列中具有更好的治疗效果。
安全性方面,联合疗法治疗组中,治疗相关的副作用大多数为1-2级。并且相对于Q3W给药,Q6W给药在发生大于等于3级副作用的概率更低:28.6% VS 18.4%。但是令人担忧的是三个队列中都出现了肝脏相关毒性,特别是队列2中。而队列三相较于单药组,3级及以上相关毒性略微升高。
虽然 BNT311/GEN1046 (acasunlimab) 的新临床特征令人鼓舞,但出于投资组合战略的原因,BioNTech 选择不参与该计划的进一步开发,包括计划中的 3 期试验。
本文作者可以追加内容哦 !

