
研究介绍
•
研究背景
Background
在正常怀孕期间,母亲的脂质代谢会经历适应性变化来满足胎儿的营养需求。Dlk1是一个印记基因,主要由父系遗传的等位基因表达。基因缺失功能研究表明DLK1是孕期脂肪酸代谢的重要调节因子。
脂肪酸对于胎儿发育十分重要。超长链多不饱和脂肪酸和长链多不饱和脂肪酸(LC-PUFA)优先从母亲转运到胎儿,这个过程被称为生物放大。无法提供LC-PUFA与死胎、胎儿生长受限、损害神经发育结局有很大关联。促进母亲和胎儿间LC-PUFA生物放大的机制还不清楚。虽然循环的脂肪组织来源的非酯化的脂肪酸可以直接转运到胎盘,甘油三酯被认为是胎儿脂肪酸的主要来源。近些年脂质组学研究提供了有关怀孕的脂质的脂肪酸组成的见解。作者推测LC-PUFA生物放大不仅来源于母亲的循环甘油三酯的产生,还可能来源于其他种类的脂质。
研究目的
Aim
作者假设在怀孕后期的血浆和肝脏中特定类别的脂质含量会协调改变;胎儿产生的DLK1对于母亲血浆和肝脏中的脂质含量有影响;母亲DLK1基因型会影响它脂质的含量。本研究还旨在探索与生物放大相关的母亲肝脏中的脂质合成通路。
研究方法
•
1、小鼠模型使用了之前研究中产生的C57BL6/J 雌鼠:未的野生型(WT)、遗传母亲的Dlk1基因缺失并保留一个有功能的Dlk1等位基因的杂合子(Mat)、Dlk1敲除的纯合子(null)(组1、6和3,组6复制组1)作为对照组。有正常胎儿来源的DLK1的WT、Mat和null怀孕鼠(组2、8和5,组8复制组2)。缺少胎儿来源的DLK1的Mat和null怀孕鼠(组7和4)。
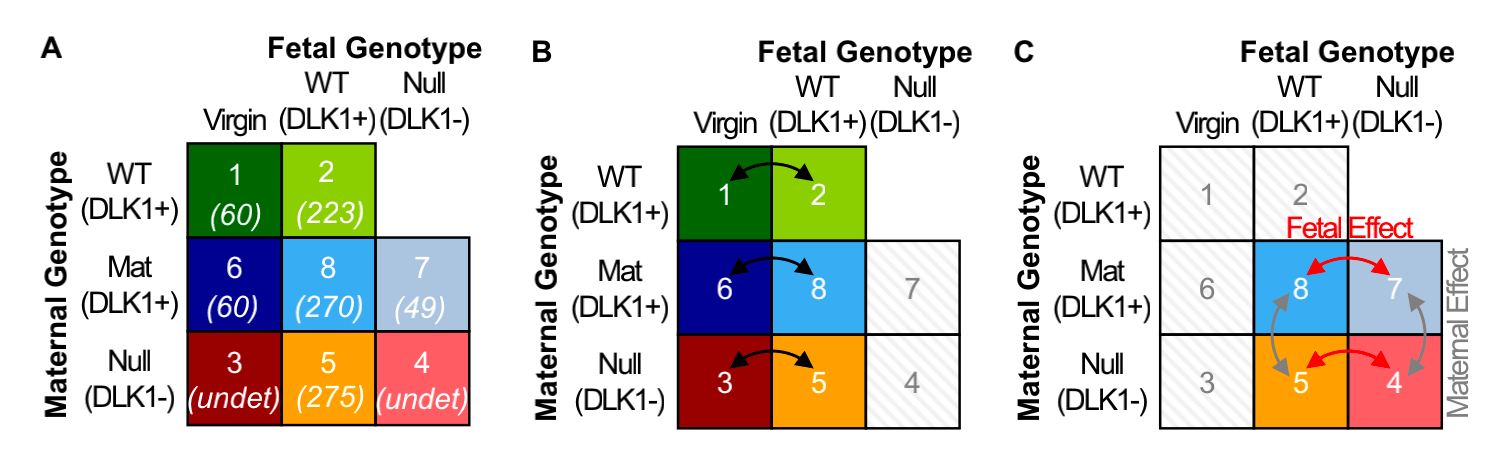
图1 研究设计
2、非靶向脂质组学使用直接输注高分辨率质谱(DI-MS)技术。靶向脂质组学使用液相色谱和串联质谱联用(LC-MS/MS)技术。
3、微阵列数据集分析肝脏样本mRNA表达,用实时定量PCR(RT-qPCR)验证。
研究发现
•
1. 妊娠晚期循环中和肝的脂质谱的变化
作者用DI-MS对基因型匹配的对照和怀孕组队列的血浆和肝样本进行非靶向脂质组学分析筛选相对丰度差异的脂质并将所得脂质组数据划分入主要脂质类别。结果发现与对照组相比,怀孕组血浆和肝脏的甘油三酯(TG)、血浆磷脂酰乙醇胺(PE)显著更高,肝脏心磷脂(CL)、血浆溶血磷脂酰胆碱(LPC)、血浆溶血磷脂酰乙醇胺(LPE)显著更低(图2a-f)。
作者还评估了DLK1对孕期的脂质谱的影响。与含正常的循环中的DLK1的怀孕小鼠相比,缺乏胎儿来源DLK1的Mat和null怀孕小鼠肝脏中PC含量上升,PE含量下降(图2i,j),表明胎儿来源DLK1对母亲孕期肝脏的PC和PE含量有影响。
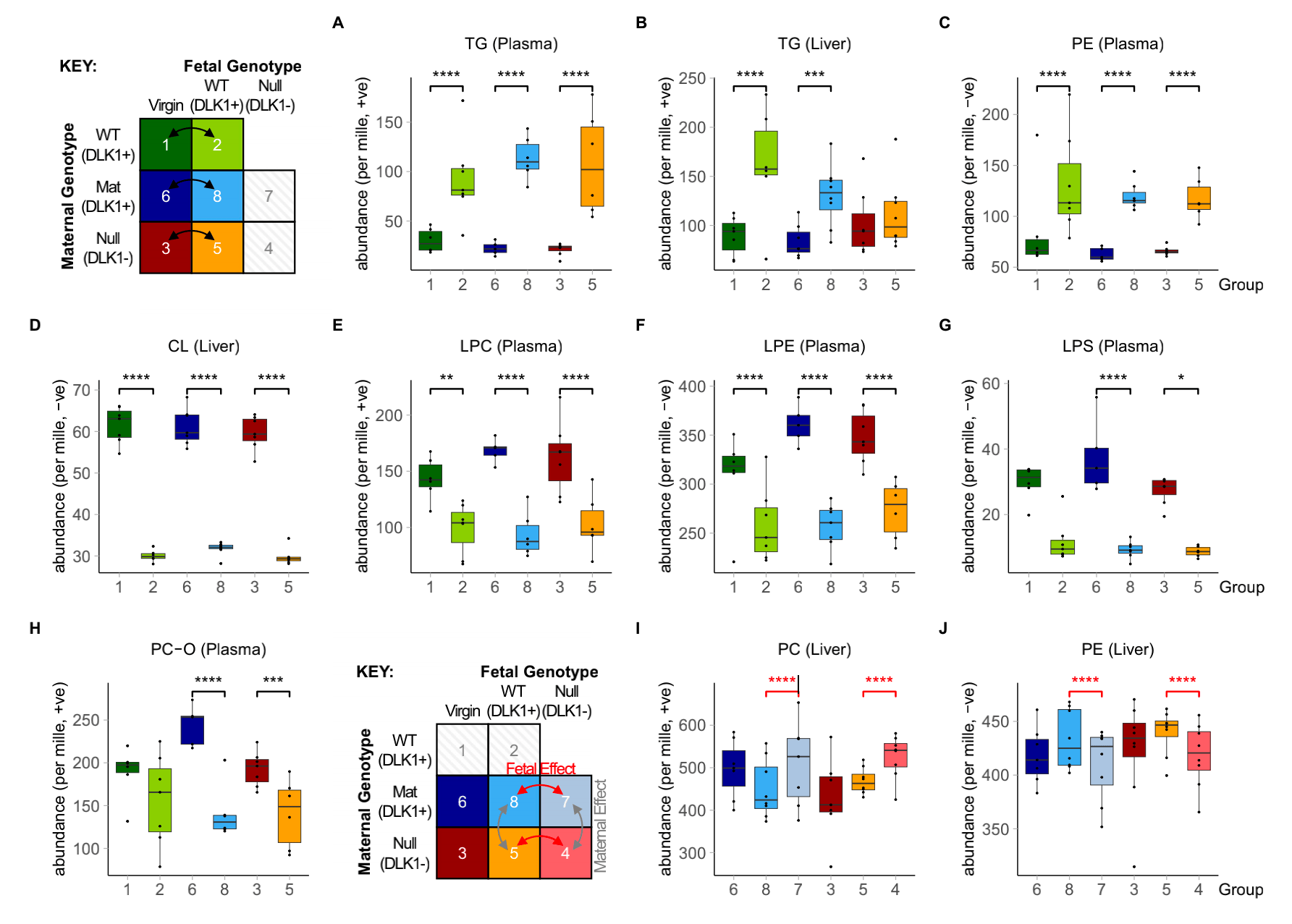
图2 孕期小鼠肝脏或血浆中变化的脂质类别
他们探究磷脂脂肪酸组成是否发生变化。他们将PC和PE基于脂肪酸链上总双键数分类。结果发现与对照组相比,怀孕组的肝脏和血浆中含有4个或4个以上双键的PC显著上升而含有3个或更少双键的PC减少(图3b)。怀孕组含有4个或4个以上双键的PE也在血浆中显著上升而含有3个或更少双键的PE在肝脏中也降低(图3c)。因此作者认为孕期这两种磷脂脂肪酸成分经历了选择性转变。
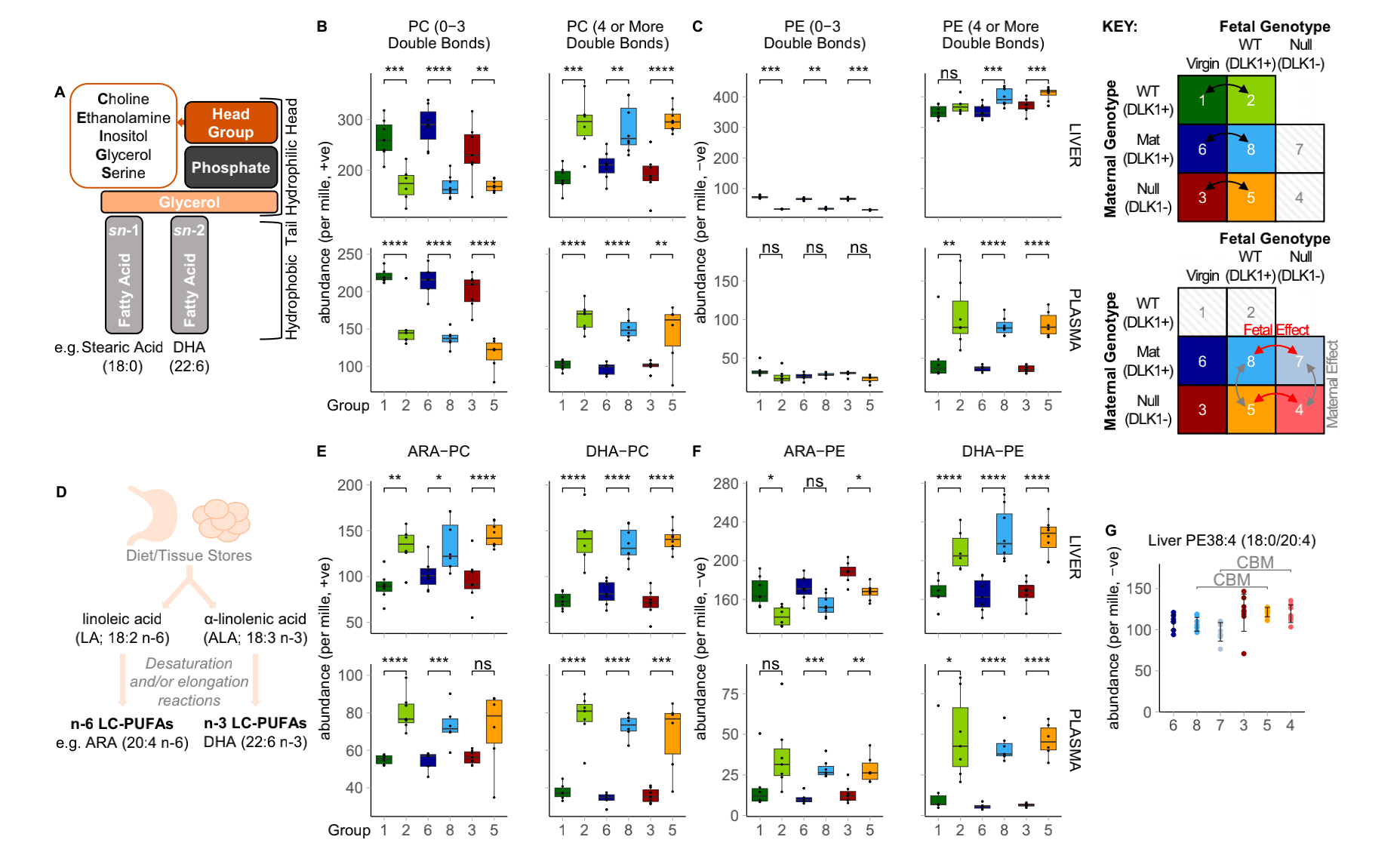
图3 孕期PC和PE中脂肪酸成分的变化
2. 妊娠晚期循环含有ARA和DHA磷脂增加
为了发现最能区分怀孕组与对照组的脂质种类,研究团队使用“候选生物标志物”(CBM)发现,靶向LC-MS/MS量化PC CBM和PE CBM的脂肪酸成分。值得注意的是,包含四个或四个以上的双键的PC(37:4、38:6、39:6、40:6)和PE(40:6)在孕期肝脏和血浆中均有升高,且含有二十二碳六烯酸(DHA)或花生四烯酸(ARA)(表1)。这些数据表明了孕期含有两种最重要的LC-PUFA的磷脂的选择性上升。肝脏和血浆中的平行变化暗示这些脂质从肝转移到循环中。
为了对怀孕相关的CBM进一步评估,他们使用一个已经发表的脂质组谱和靶向LC-MS/MS进行比较。与对照组相比,ARA-PC、DHA-PC和DHA-PE在孕期的小鼠肝脏和血浆中均显著更加丰富(图3e,f),表明妊娠晚期含有LC-PUFA磷脂的增加,孕期母亲肝脏选择性促进含有ARA和DHA的磷脂的产生和输出。
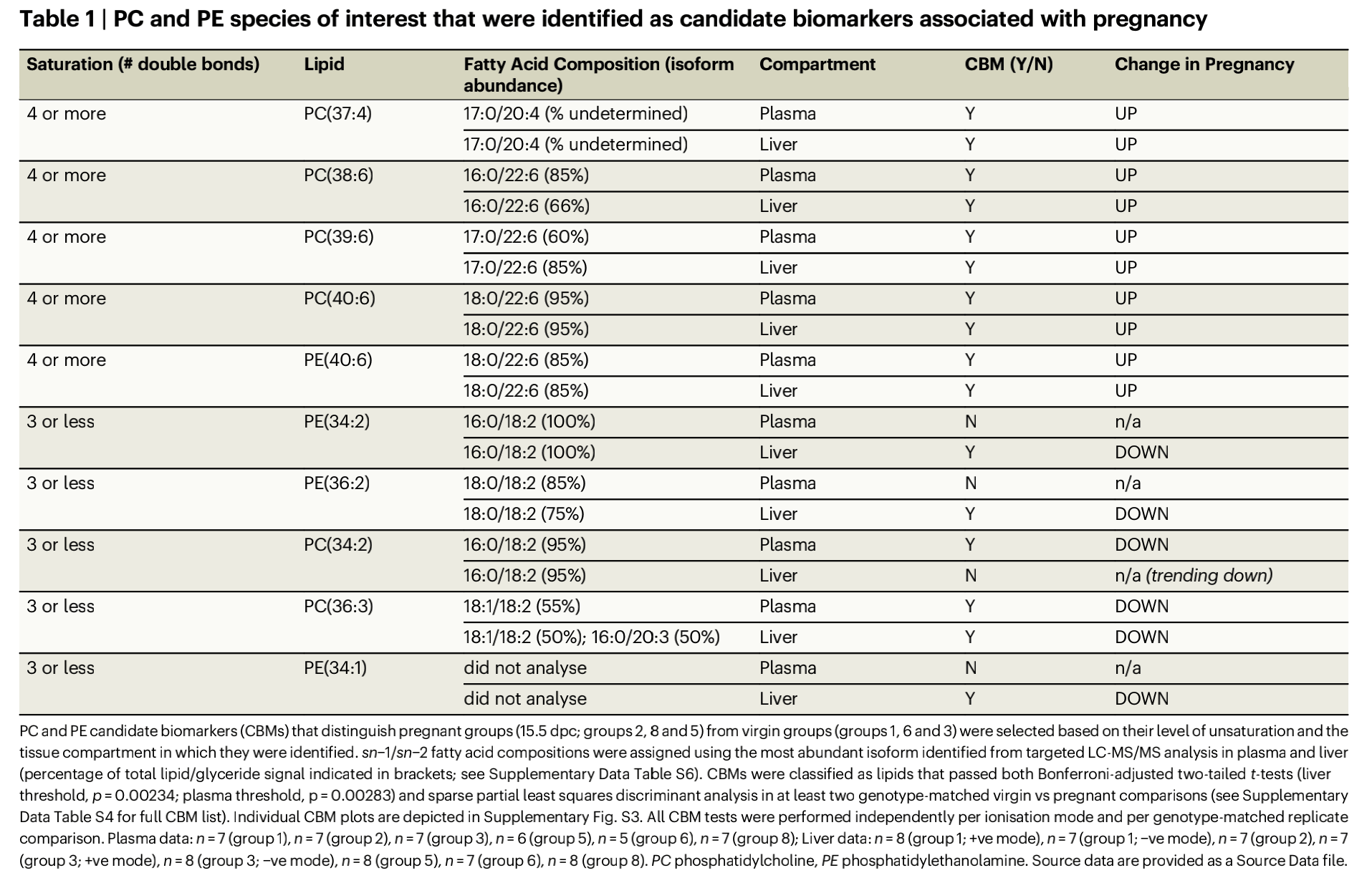
表1 被识别为候选生物标志物的与怀孕相关的PC和PE种类
3. 孕期肝脏LC-PUFA-磷脂的生物合成和输出的转录变化
作者猜测参与LC-PUFA-磷脂的合成与输出的酶的通路是妊娠晚期肝脏的适应的重要靶点。他们重新分析一个已发表的比较怀孕和对照小鼠肝脏的全转录组微阵列数据集,发现了差异表达的基因(图4b)。感兴趣的差异表达的生物合成基因在图4c中显示。图4d展示了肝脂质生物合成通路的转录变化。然后作者用RT-qPCR分析验证本研究怀孕和对照组的肝脏样本的靶基因表达变化(图4e-i)。
作者首先探究孕期肝脏LC-PUFA的来源。ARA和DHA的来源可能是从进食或脂肪动员进入肝脏或可能由n-3和n-6 PUFA前体合成,对于任一情况,肝脏ARA和DHA来源需要脂肪酸注入。结果发现CD36(肝脏脂肪酸摄取的主要调节转运体)、Fads1和Fads2(编码LC-PUFA合成中的限速酶delta-5和delta-6去饱和酶)的表达上调(图4d,f),支持了母亲肝脏中脂肪酸注入和接着的n-3和n-6 PUFA去饱和。怀孕组肝脏的Gpam上调(图4g),Agpat2和Agpat3分别下调和上调(图4d,g),AGPAT3特异催化DHA-PA产生。Pcyt1a也在怀孕组肝脏中增加(图4d,g)。因此怀孕期间选择性适应可能促进AGPAT3介导的含有DHA的PC的合成。

图4 孕期肝脏LC-PUFA-磷脂生物合成通路的转录分析
与表达DLK1的怀孕鼠相比,缺乏DLK1表达的怀孕鼠展现出Fads1,Fads2,Pcyt1a,Pnpla3,Mttp表达升高(图5a-d),表明在怀孕时DLK1显著增加了LC-PUFA-磷脂相关的转录应答。
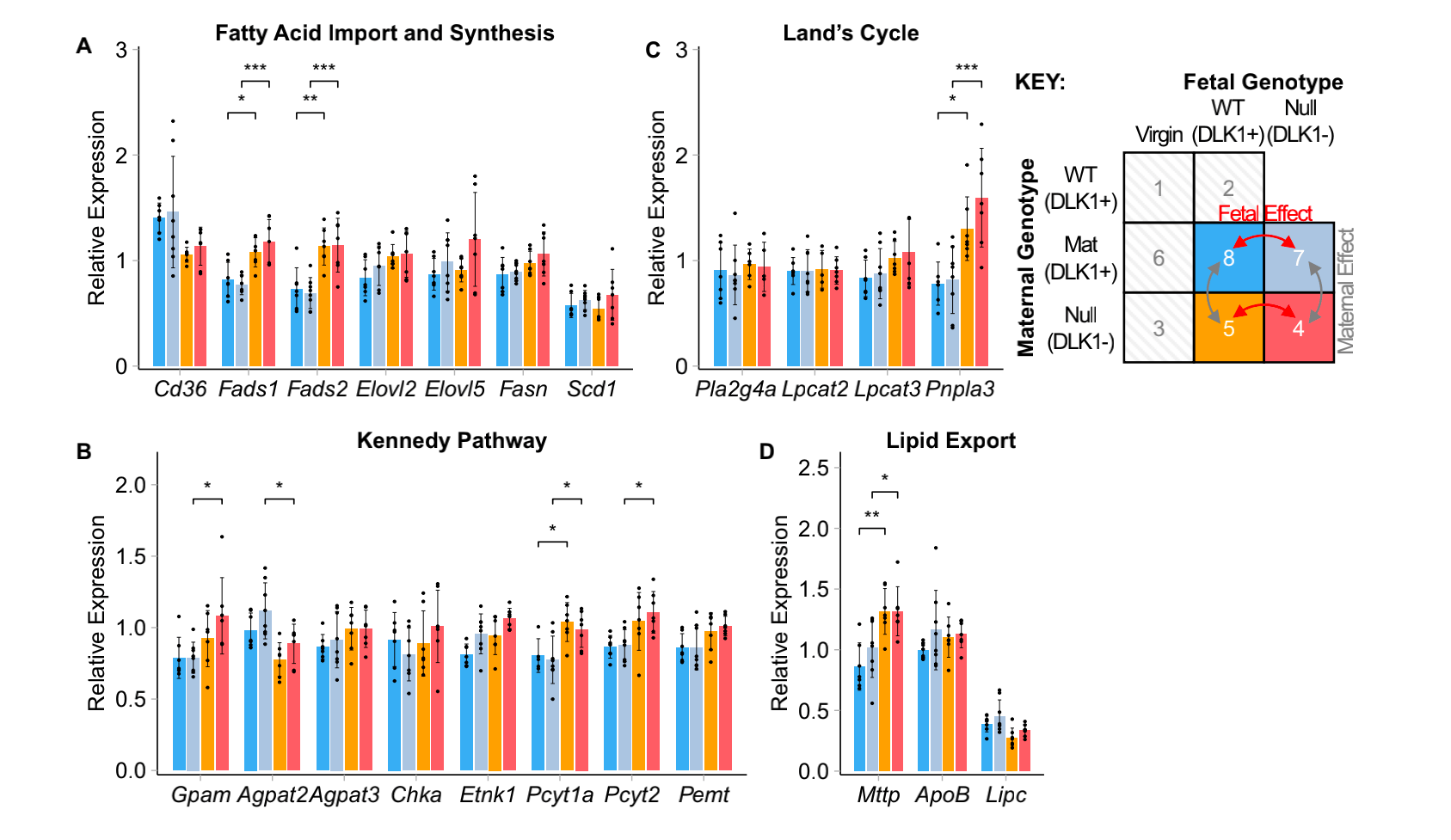
图5 Dlk1改变后的肝脏LC-PUFA-磷脂生物合成基因的表达
研究讨论
•
作者认为这些发现挑战了长期以来甘油三酯作为提供给胎儿LC-PUFA的主要来源。作者提出了重要的合成通路促进LC-PUFA-磷脂在孕期升高。第一,他们报道了在孕期Fads1和Fads2表达增加介导的LC-PUFA的合成上调。第二,Kennedy通路相关基因转录水平在怀孕期间发生改变,作者认为怀孕期间肝脏中的适应性机制靶向Kennedy通路以促进DHA-磷脂合成。除此以外,他们发现在孕期缺乏Dlk1表达会增加LC-PUFA-磷脂肝脏合成限速步骤相关基因的转录。
这个研究使用了DI-MS产生了怀孕小鼠肝脏的脂质组谱。因为它不能够分辨脂质中的脂肪酸组成,假设基于总碳和双键含量。作者用CBM管道和LC-MS/MS靶向分析得到假设的脂质的脂肪酸组成,并用DI-MS信号证实。
总结
研究意义
这个研究分析了对照和怀孕小鼠的肝脏和血浆的脂质组,揭示了ARA和DHA以磷脂的形式在母亲肝脏和循环中富集;怀孕后期肝脏中由膳食中间体合成LC-PUFA与将其并入磷脂的转录通路被激活,强调了怀孕状态对于脂质代谢的影响。
参考文献
[1] Amarsi, R., Furse, S., Cleaton, M. A. M., Maurel, S., Mitchell, A. L., Ferguson-Smith, A. C., Cenac, N., Williamson, C., Koulman, A., Charalambous, M. (2024). A co-ordinated transcriptional programme in the maternal liver supplies long chain polyunsaturated fatty acids to the conceptus using phospholipids. Nat Commun. 15, 6767. doi: 10.1038/s41467-024-51089-z.
END
文案 | Linsey
排版 | Linsey
审核 | Linsey
发布|姜笑南
世界生命科学大会
RECRUIT
关注我们,获取生命科学
学界前沿|促进更多的学术交流与合作
业界前沿|促进更快的产品创新与应用
政策前沿|促进更好的治理实践与发展
我们期待你的加入
本文作者可以追加内容哦 !

