
在“减重经济”的影响下,司美格鲁肽、利拉鲁肽因功效显著而火爆全球,一度被奉为“减肥神药”。GLP-1成为年度药品的现象级存在。然而,此类药物却存在导致自杀的风险,“减肥神药”是否会跌下神坛?
2023年6月,欧洲药品管理局 (EMA)宣布,开始对包括司美格鲁肽在内的GLP-1受体激动剂相关风险作出审查。起因是冰岛卫生监管机构收到报告:有三例患者在使用司美格鲁肽或利拉鲁肽后,出现了自杀或自残的念头。
自此,聚光灯下的GLP-1赛道,进入了冷静期。
当地时间1月11日,美国食品药品监督管理局(FDA)公布了对胰高血糖素样肽-1受体激动剂(GLP-1 RA)类药物,是否会导致患者自杀意念或行为的初步评估结论。调查涵盖FDA已批准的13种GLP-1 RA类药物,初步评估并没有发现会导致自杀意念或行为的证据。
美国FDA还建议患者在未咨询医生或未经医生建议的情况下不要停止GLP-1治疗,因为可能会加重病情;建议医生和保健专业人员密切监测患者是否有恶化的抑郁症、自杀念头、情绪和行为的变化。
自杀副作用现身,多国重视
目前,肥胖已经成为危害健康的严重公共卫生问题。依据《中国居民肥胖防治专家共识》的统计数据,自1990年以来,中国成年人中超重及肥胖的患病率平均每年增长1%。从1992年的 20%增长到2018年的50.7%。
肥胖不仅是身体健康的“万恶之源”,也是多种慢性病的重要诱因。根据《肥胖的流行病学现状及相关并发症的综述》的数据,在过去的20年间,中国超重率、肥胖率,以及相关慢性病的患病率迅速攀升。一项针对中国上海地区18739名成年人调查研究显示,高血压、高血糖、高血脂、高尿酸血症等常见慢性病与BMI指数呈现显著正相关性。其中高血压在肥胖人群检出率约为正常人6倍,高血糖在肥胖患者检出率约为正常人5倍。
GLP-1(胰高血糖素样肽1)是一类多肽药物,用于治疗2型糖尿病患者、肥胖或超重患者。
其药理机制为通过刺激GLP-1受体增加胰岛素的分泌,以及抑制胰高血糖素的分泌,从而达到降糖的目的。
此前,GLP-1类药物宣称“既安全又有效”还“敢用想用” 。因此,GLP-1类药物在追求效率的减重人群中也颇受关注。
而在2023年7月,欧盟药品管理局官网披露的药物警戒风险委员会(PRAC)的月度会议成果显示,诺和诺德的利拉鲁肽被检测出有“自杀和自残”的副作用倾向。
此前,冰岛药品管理局提出三份使用诺和诺德旗下两款产品的病例报告,其中两例出现自杀倾向,一例出现自残倾向。
据悉,两款产品中的重要活性成分分别为司美格鲁肽和利拉鲁肽,皆为GLP-1受体激动剂类药物。
诺和诺德方面表示,“大型临床试验项目数据和上市后监测期间采集的数据均未显示司美格鲁肽或利拉鲁肽与自杀或自残意图之间存在因果关联。”
欧盟药品管理局则提出,将会重点调查司美格鲁肽、利拉鲁肽在自杀、自残方面的影响作用,同时,药物警戒风险评估委员会正考虑将调查范围扩大到所有GLP-1类药物。
美国医生在开具日用的Saxenda(利拉鲁肽)的处方信息中包含一项建议,即监测患者是否有抑郁或自杀念头,并在出现症状时停止服药。
英国药品和保健品监管局(MHRA)也于2023年7月启动审查丹麦药企诺和诺德旗下的GLP-1类药物。并提出在2010年到2023年7月6日期间,MHRA还收到了12起涉及利拉鲁肽的“疑似药物不良反应”案件,也与“自杀或自残行为”有关。不过该机构强调,报告尚不能证明之间存在因果关系。
或将影响大量临床研究
减肥神药“造祸于人”,此前的确发生过。
上世纪90年代中期,一款宣称毫不费力减重的“奇迹药物”登陆欧洲市场,就是芬氟拉明与芬特明联合用药,简称为“芬芬疗法”。使用这个疗法,一个体重超300磅的30+女性,几个月内便掉秤超25磅。
惊人的减肥效果引来多数人争相使用。直至一些患者的心脏瓣膜出现问题,但当时并未引起重视,因为这一疗法在Ⅲ期临床试验中并未发现引发心脏瓣膜或其他心血管问题的任何迹象。
最终,一项研究表明了“芬芬疗法”与心脏瓣膜损害之间的关系,FDA因此要求相关产品下架。
实际上,在关注到司美格鲁肽、利拉鲁肽导致自杀、自残倾向之前,欧盟药品管理局曾提出GLP-1类药物致甲状腺癌的风险较高,对涉及药企诺和诺德、礼来、赛诺菲、阿斯利康均提出警告。
欧盟药品管理局对于GLP-1类药物的安全性担忧,源于2022年11月,《糖尿病护理》杂志上刊登的一篇名为《GLP-1受体激动剂与甲状腺癌的风险》的研究。
结果显示,在2006年至2018年期间接受二线治疗的2型糖尿病患者中,分析2572名甲状腺癌患者和45184名未患甲状腺癌患者的数据发现,与不使用GLP-1类药物的患者相比,使用GLP-1类药物1-3年或超过3年的患者高甲状腺癌发生率更高。鉴于这一临床结果,EMA对于GLP-1类药物的安全问题产生怀疑。
美国方面,由于诺和诺德此前在动物实验中发现了甲状腺癌与活性司美格鲁肽之间可能存在联系,因此FDA直接给予黑框警告,同时指出有甲状腺癌家族史的患者不应服用该药物。
黑框警告是美国食品药品管理局(FDA)要求在处方药的说明书上写明的一种对药物不良反应的警告标志,是最高级别的警告,代表该药物具有引起严重的、甚至危及生命的不良反应的重大风险。
多方监管政策趋严,使得原本火热的GLP-1赛道进入冷静期。
德邦证劵显示,GLP-1类药物近三年临床申报处于爆发期。仅2023上半年临床申请数量就已超过2022全年,足可见GLP-1类新药研发的火热。
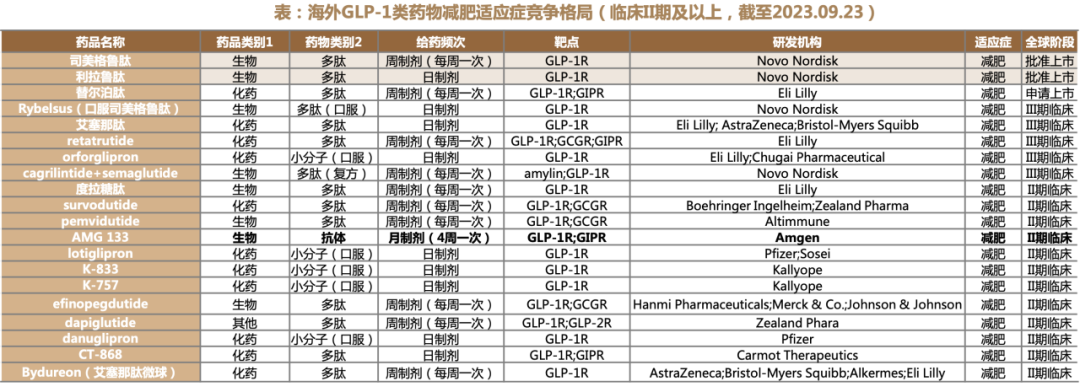
除了礼来、诺和诺德外,国内药企也抢滩发力。华东医药已拥有至少9个GLP-1类药物,利拉鲁肽注射液“适用于成人2型糖尿病患者控制血糖的上市许可申请于2023年3月获得批准,成为目前唯一上市的国产利拉鲁肽,肥胖适应症于2023年7月获批上市。
GLP-1类药物副作用的出现,势必会使国内外相关赛道药企面临被动形势,此次FDA的回应,是否会打破僵局,仍需持续关注。
本文作者可以追加内容哦 !

