8月26日,再生元宣布旗下双抗治疗CD3/CD20双抗odronextamab在欧盟获批上市,用于治疗至少接受过两种系统治疗的复发性或难治性弥漫性大B细胞淋巴瘤(R/R DLBCL)和滤泡性淋巴瘤(R/R FL)。
Odronextamab是再生元首次获批的双抗,它将提供一种现成的治疗选择,可在门诊环境中给药,有望实现完全缓解。

Odronextamab是再生元开发的一款CD3/CD20双特异性抗体,可同时结合癌细胞上的CD20和T细胞上的CD3,从而促进局部T细胞活化和癌细胞杀伤。EMA此前已授予odronextamab治疗FL和DLBCL的孤儿药资格。
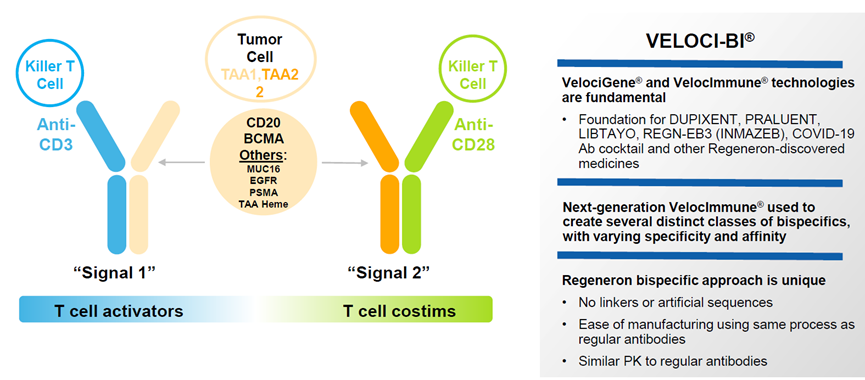
此次获批主要是基于I期ELM-1研究和II期ELM-2研究的积极结果,这些试验结果证实odronextamab在R/R FL与R/R DLBCL成人患者中强劲、持久的缓解作用。
ELM-1研究是一项正在进行的多中心、开放标签I期临床试验,旨在评估Odronextamab在接受过CD20靶向抗体药物治疗的CD20阳性(CD20+)B细胞恶性肿瘤患者中的安全性和耐受性,其中包括一个接受CAR-T疗法治疗后疾病进展的DLBCL患者的扩展队列。
该研究的整体客观缓解率ORR为51%.在接受5mg或者更高治疗剂量的FL患者中,ORR高达91%,CR为72%;而在之前未接受过CAR-T治疗的DLBCL加患者中,接受80mg或者更高的剂量时,Odronextamab治疗的ORR为53%,CR为53%;在入组前已经接受过CAR-T治疗的组中,Odronextamab治疗的整体ORR为33%,CR为27%。
ELM-2研究是一项正在进行的多中心、开放标签关键II期临床试验,共纳入375例患者,包括DLBCL、FL、套细胞淋巴瘤(MCL)、边缘区淋巴瘤(MZL)和其他B细胞非霍奇金淋巴瘤(B-NHL)亚型5个独立的疾病特异性队列。研究的主要终点是客观缓解率(ORR)。
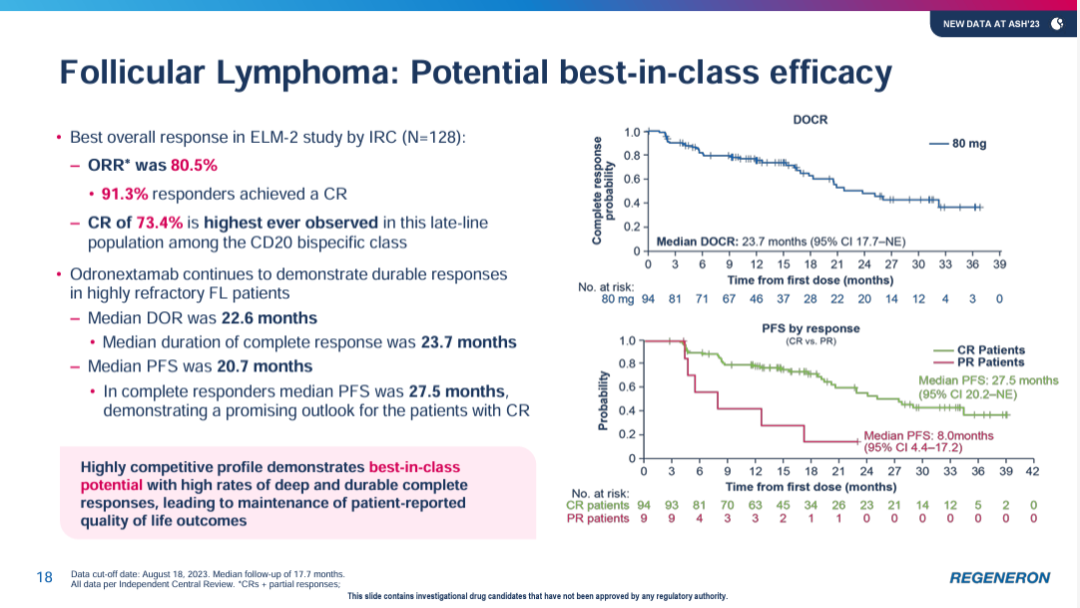
此前ASH会议上公布的ELM-2研究结果显示,在121例≥3线的DLBCL患者,90例符合有效性分析,随访17.1个月时ORR和CR分别为53%和37%,而且疗效持久性较好,9个月时持续CR率为73%。同样,在96例3线及以上FL患者中,85例患者评估的ORR和CR分别为82%和75%。
然而,Odronextamab的研发上市之路并非一帆风顺。
2020年12月,Odronextamab部分临床试验就被FDA叫停,FDA要求再生元进一步降低3级细胞因子释放综合征(CRS)的发生率。此后,该公司不得不在临床前修改试验方案,该项禁令部分已于2021年5月解除。
今年3月,再生元Regeneron宣布,FDA拒绝其CD3/CD20双抗Odronextamab治疗复发性或转移性滤泡淋巴瘤(FL)和弥漫大B细胞淋巴瘤的上市申请,再生元表示唯一原因是确证临床的入组状态问题,FDA在完整的回复函(CRL)中没有发现任何与有效性、安全性、试验设计、标签或制造有关的问题。
FDA此前已授予Odronextamab孤儿药认定,以及治疗DLBCL和FL的快速通道认定,根据GlobalData数据,该药预计将在2029年创造6.16亿美元的全球销售额。
CD3/CD20为目前竞争最为激烈的双抗靶点组合之一。FDA批准了3款CD3×CD20双抗上市,包括罗氏开发的2款:Glofitamab和Mos
本文作者可以追加内容哦 !

