Claudin18.2 ADC一度是ADC领域的热门赛道,如今却遭遇了市场预期的转折。
从全球首款Claudin18.2单抗Zolbetuximab获批,到Elevation披露EO-3021的最新临床数据不佳,再到默沙东退回科伦博泰SKB315的全球权益,透露出Claudin18.2 ADC市场竞争的加剧和急需寻找突破口的焦虑。
在此关键时刻,德琪医药公布了ATG-022对Claudin18.2极低表达水平患者产生治疗响应的临床数据,似乎又带来了新的曙光。
国产药企会如何把握Claudin18.2 ADC领域的新机遇,找到属于自己的“出路”?
01
Claudin18.2 ADC赛道:
从火热到降温
Claudin18.2 ADC之所以备受瞩目,主要是由于目前全球尚未诞生首款Claudin18.2 ADC,且赛道频频达成对外授权交易。
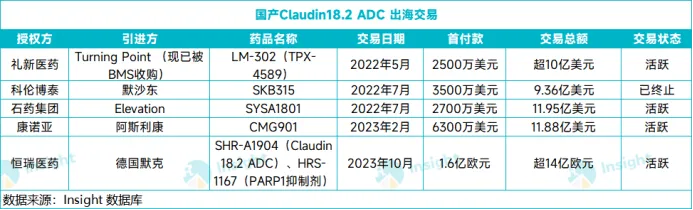
此前,共有5款国产Claudin18.2 ADC获得海外药企青睐,包括礼新医药LM-302(TPX-4589)授权给Turning Point Therapeutics(后被BMS收购)、科伦博泰SKB315授予默沙东(2024年8月被退回权益)、石药集团SYSA1801授予Elevation、康诺亚/乐普生物CMG901授予阿斯利康、恒瑞医药SHR-A1904授予德国默克,5笔交易潜在总金额合计超过50亿美元。
然而,今年以来一连串的变化,改变了Claudin18.2 ADC赛道的市场预期。
3月,安斯泰来开发的Zolbetuximab在日本获批一线治疗Claudin18.2阳性、HER2阴性胃癌适应症,诞生了全球首款Claudin18.2单抗。而且,除了单抗、ADC,还有靶向Claudin18.2的双抗、CAR-T等多种药物类型,正在如火如荼的研发当中。
尤其8月份的两则消息,更是让原本火热的赛道降了降温:先是Elevation公布了Claudin18.2 ADC药物EO-3021(SYSA1801)的最新临床数据不佳,接着科伦药业披露默沙东退回了控股子公司科伦博泰SKB315的全球权益。
8月6日,Elevation公布EO-3021在美国开展Ⅰ期临床的最新临床结果:15位可评估患者中的响应率仅为20%,远不及此前在中国进行Ⅰ期临床的数据(响应率达47%),且Claudin18.2低表达患者无PR,安全性也并不突出。消息一出,Elevation oncology股价单日暴跌63%。
8月19日,科伦药业发布公告称:默沙东以3750万美元预付款引进科伦博泰一款临床前双抗ADC SKB571项目,同时退回Claudin18.2 ADC SKB315的全球权益。
起初,默沙东引进SKB315,是看好Claudin18.2 ADC在胃癌治疗领域的市场前景。但如今,市场环境已经发生重大变化,在研管线数量多且已有多款处于临床后期阶段。
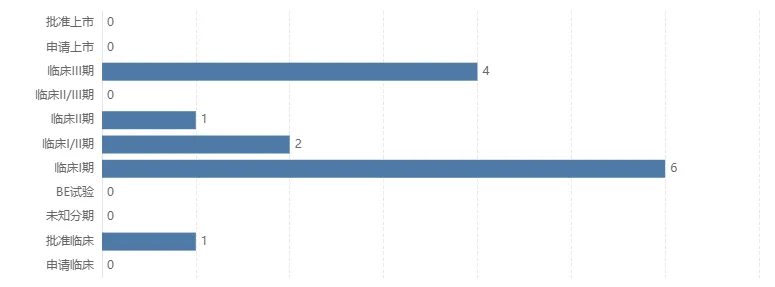
Insight数据库显示,目前国内已有4款Claudin18.2 ADC进入Ⅲ期临床,分别为信达生物IBI343、康诺亚/乐普生物CMG901、礼新医药LM-302(TPX-4589)和恒瑞医药SHR-A1904。
面对如此激烈的竞争环境,如何脱颖而出成为了药企必须深思的问题。
02
新的曙光?
就在Claudin18.2 ADC赛道风云变幻之际,德琪医药公布了ATG-022对Claudin18.2极低表达水平患者产生治疗响应的临床数据。
德琪医药在2024年中期报告中披露,处于Ⅱ期临床研究阶段的ATG-022,不仅在Claudin18.2中高度表达的胃癌患者中显示了疗效,还为低表达和极低表达的患者带来了临床获益。基于这些具有突破性意义的临床数据,ATG-022有望成为全球同类最优药物。
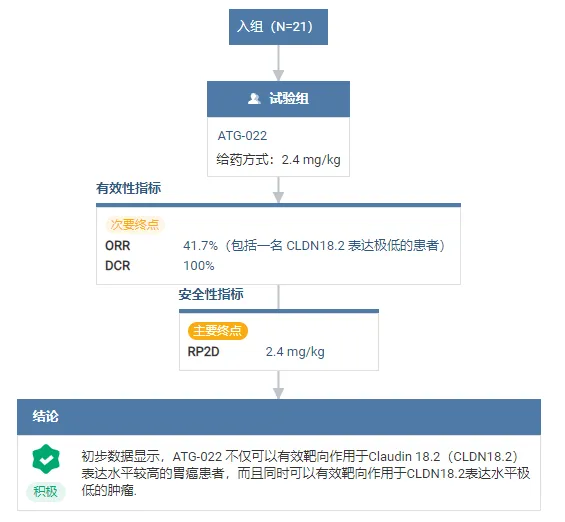
根据正在进行的II期CLINCH剂量扩展研究数据显示,截至8月21日,已有21例Claudin18.2阳性的胃癌患者接受了ATG-022治疗。在12 例至少接受了一次治疗后肿瘤评估的患者中,5例获得了部分缓解(PR)。总体缓解率(ORR)为41.7%(包括一名Claudin18.2表达极低的患者),疾病控制率(DCR)为100%。目前,II期CLINCH研究正在中国和澳大利亚顺利开展中。
此前,ATG-022已获得美国FDA授予2项孤儿药资格认定(ODD),分别用于治疗胃癌和。
CLINCH 研究总览图
截图来源:Insight数据库
Claudin18.2之所以会成为热门研发靶点,是由于过度表达、胃癌、食道癌等实体瘤,极具市场潜力。
不过,Claudin18.2高表达胃癌仅占全部胃癌的24%-36%,而目前除ATG-022之外的其他Claudin18.2 ADC主要披露了对中高表达胃癌患者的疗效,尚未披露出对低表达胃癌患者有效的临床数据。
可以说,ATG-022的突破,为Claudin18.2 ADC的研发带来了新的曙光。
要知道,Claudin18.2 ADC之所以备受瞩目,就在于ADC药物具有独特的作用机制,可通过“旁观者效应”在 Claudin18.2低表达胃癌人群中实现突破。相较之下,安斯泰来研发的全球首款Claudin18.2单抗Zolbetuximab,仅对Claudin18.2高表达胃癌患者有效,覆盖患者人群比例有限。
正如HER2 ADC领域的Enhertu(DS-8201),之所以能超越Kadcyla拿下ADC“药王”宝座,不仅在于获批了HER2阳性乳腺癌、胃癌和非小细胞肺癌,更在于史无前例的攻克了HER2低表达乳腺癌,使得2023年销售额实现翻倍增长至25.56亿美元。
当然,ATG-022仍处于临床早期阶段,最终能否成功拿下低表达胃癌患者这一适应症,还有待后续临床的验证。
03
4款国产进入Ⅲ期,
谁能率先突围?
在激烈的竞争环境下,国产药企要想脱颖而出,或是加快研发速度、不断优化药物组合方案,或是积极拓展新治疗领域、实现差异化突围。
目前,已有4款国产Claudin18.2 ADC处于临床Ⅲ期阶段,分别为信达生物IBI343、康诺亚/乐普生物CMG901、礼新医药LM-302(TPX-4589)和恒瑞医药SHR-A1904。
国内 Claudin18.2 ADC 研发进度分析
截图来源:Insight数据库
信达生物除了开展IBI343单药治疗以外,还探索IBI343联合PD-1抑制剂信迪利单抗一线治疗胃或胃食管交界处腺癌(GC),以及联合雷莫西尤单抗二线治疗GC的POC研究。
在2024 ESMO GI会议上,信达生物口头报告了IBI343治疗晚期G/GEJ腺癌的I期研究(NCT05458219)最新数据:针对Claudin18.2高表达(IHC 2+≥75%)受试者,6mg/kg剂量组的客观缓解率(ORR)为36.7%、疾病控制率(DCR)为93.3%,中位无进展生存期(PFS)达6.8个月;8mg/kg剂量组的ORR为47.1%,DCR为88.2%,中位PFS达5.5个月。
CMG901由康诺亚与乐普生物共同研发,此前于2023年12月获FDA快速通道资格认定,用于单药治疗复发或对已批准疗法耐药的不可切除或转移性胃癌和胃食管交界处癌(GEJ)患者。
在2024 ASCO年会上,康诺亚口头报告了CMG901治疗晚期胃癌/胃食管结合部腺癌的I期临床研究最新数据:89例可评估Claudin18.2高表达受试者在三个剂量组的ORR为35%,DCR为70%。在2.2 mg/kg剂量组中观察到的ORR为48%。所有93例Claudin18.2高表达受试者的中位无进展期(mPFS)为4.8个月,中位总生存期(mOS)为11.8个月。
阿斯利康在2023年2月引进了CMG901(AZD0901)的权益,目前正在开展AZD0901单药治疗Claudin18.2+胃癌/GEJ(先前接受最多2L治疗),以及联用化疗一线治疗的II期临床。
恒瑞医药也针对SHR-A1904开展了联合疗法研究。今年4月,SHR-A1904联合阿得贝利单抗治疗晚期实体瘤在国内进入Ⅲ期临床。其中,阿得贝利单抗是我国首个获批小细胞肺癌适应症的自主研发PD-L1抑制剂。
格外值得一提的是,在礼新医药宣布与Turning Point Therapeutics就LM-302达成海外授权合作不久,百时美施贵宝(BMS)就宣布斥资41亿美元收购Turning Point Therapeutics。
在2024 ASCO大会上,礼新医药披露了LM-302针对Claudin18.2阳性(IHC 2+≥50%)患者的I/II期临床数据:36例可评估疗效患者中,11例达到PR,ORR为30.6%,DCR为75.0%。中位PFS为7.16个月(95%置信区间为2.72个月至未达),中位总生存期(OS)尚未达到,截至2023年11月15日,6个月OS率为95.0%。
04
结语
当前,Claudin18.2 ADC领域正经历从热潮到冷静的转变,市场竞争随药企的争相涌入而愈发激烈。
药企要想在此领域占有一席之地,不仅要在药物研发上实现突破,还得拥有强大的商业化能力和精准的市场布局。就看哪家国内药企能率先突围,问鼎江湖。
参考资料:
1.各家公司的财报、公告、官微
2.Insight数据库
$德琪医药-B(HK|06996)$ $恒瑞医药(SH600276)$ $信达生物(HK|01801)$
@东方财富创作小助手 #“中国神船”来了!股价影响几何?# #A股9月未能开门红,后市怎么走?# #【有奖】新科技和快出海,如何影响家电业?#
本文作者可以追加内容哦 !

