
本文转自公众号:医休研究院、医休器械(yixiuqixie.com)
近日,真健康(珠海)医疗科技有限公司的“导航定位微波消融系统”创新器械获得国家药品监督管理局批准注册。

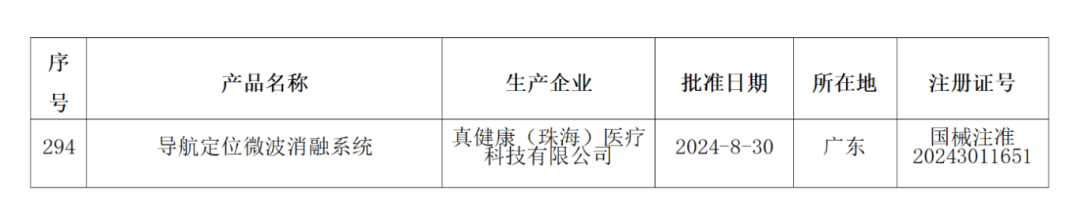
导航定位微波消融系统由主控台车(含机械臂、脚踏开关)、微波治疗台车(含光学跟踪模块、脚踏开关)、导航定位工具、微波传输线、一次性使用微波消融针及一次性使用测温针组成。该产品可在术前基于CT图像制定进针计划,术中引导微波消融针进行经皮穿刺手术,用于成人肝脏实体肿瘤的微波消融。

*导航定位微波消融系统
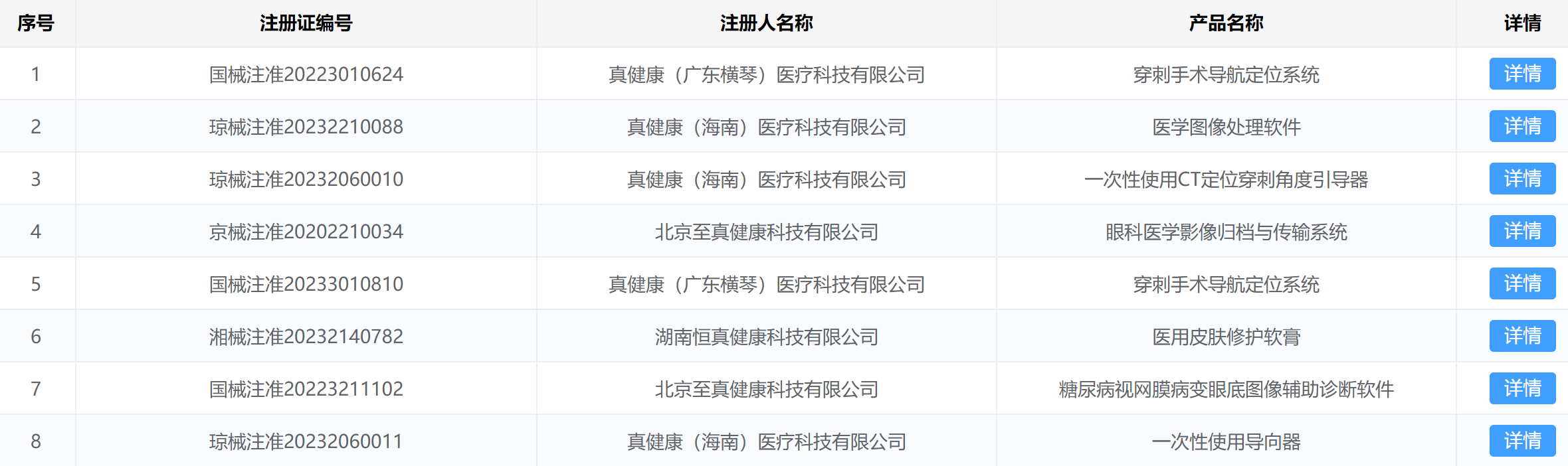
与传统微波消融设备相比,该产品创新性地融合了导航定位技术、呼吸跟踪技术和微波消融技术,为国际首创。有效提高临床微波消融针置针、病灶靶区消融的精准度以及消融手术效率和成功率,降低对医生穿刺、消融规划经验的要求,提高穿刺消融治疗的有效性和安全性。除导航定位微波消融系统外,真健康已经获得了8张医疗器械注册证,其中两款是穿刺导航定位系统。

真健康(广东横琴)医疗科技有限公司成立于2018年3月,是一家将人工智能与机器人技术相结合,以解决真实临床应用场景中高频医疗痛点为目标的医疗手术机器人科技公司。真健康于2019年获得中关村高新技术企业证书,2020年获得国家高新技术企业证书,2021年获得医疗器械质量管理体系认证证书,2022年获得“专精特新”中小企业认证。在今年7.30号完成了B+的融资,投资方为太平医疗健康基金、横琴深合产业投资有限公司。自从2021年对外融资以来,集结了雅瑞天使、金科君创、香港X科技基金、高榕资本、水木创投、KIP、横琴金投、理工创动、瑞昇基金、华金资本、珠海高科创投、中金资本等众多投资机构。
穿刺手术导航定位系统技术审评报告
(另外一款,不是导航定位微波消融系统)
产品中文名称:穿刺手术导航定位系统,产品管理类别:第三类,申请人名称:真健康(北京)医疗科技有限公司
基本信息
一、申请人名称
真健康(北京)医疗科技有限公司
二、申请人住所
北京海淀区永泰庄北路1号天地邻枫2号楼3层308室
三、生产地址
北京市北京经济技术开发区科创十四街99号33幢B栋9层905室
技术审评概述
一、产品概述
(一)产品结构及组成
该产品由主控台车、光学跟踪系统、机械臂台车、导航定位工具组成。
(二)产品适用范围
该产品适用于成人肺及腹部实体器官穿刺手术的导航定位。
(三)型号/规格
TH-S
(四)工作原理
该产品通过图像配准、导航跟踪、呼吸追踪、机械臂控制、导向规划、导向定位等功能实现其预期用途。术前以CT等医学影像数据为基础完成患者三维影像重建,医生基于图像制定手术计划;术中通过图像配准,建立图像坐标系和患者坐标系的映射关系;基于术前路径规划,控制机械臂到达预定位置,实现手术器械的定位;基于呼吸追踪技术,动态追踪患者呼吸状态,辅助医生在最佳呼吸相位下完成穿刺手术。
二、临床前研究概述
(一)产品性能研究
产品性能包括产品外观、导航配准精度、位置准确度、位置重复性、系统精度、最大空间、有效空间、机械臂有效操作力、机械臂负载承载力、机械臂启动力、采样频率、同时跟踪参考元件的最大数量、系统功能(包括系统管理、患者管理、图像显示、图像配准、导航跟踪、呼吸追踪、机械臂控制、导向规划、导向定位、手术器械标定、数据备份与恢复、距离和角度测量、网络安全、接口、使用限制、包含功能、操作模式)、导航定位工具性能(外观、尺寸、硬度、耐腐蚀、装配牢固性、适配性能)、机械接口、脚踏开关、电气安全要求、电磁兼容要求等。
申请人提交了产品性能、呼吸追踪、图像配准、运动仿真等研究资料,并提交了产品技术要求与产品检测报告,检测结果与产品技术要求相符。
(二)生物相容性
该产品所含导航定位工具中的E-工具追踪器及套筒与人体表面短期接触。
申请人根据GB/T 16886.1-2011医疗器械生物学评价第1部分:风险管理过程中的评价与试验》进行了生物相容性评价,产品生物相容性风险可接受。
(三)灭菌
导航定位工具以非无菌状态提供,使用前由用户灭菌,其中含有ABS材质的导航定位工具(如E-工具追踪器)采用环氧乙烷灭菌或过氧化氢等离子灭菌;不锈钢材质的导航定位工具(如E-导向器、E-套筒Ⅱ)采用压力蒸汽灭菌;申请人提供了终端用户灭菌及残留毒性的研究资料,符合要求。
(四)产品有效期和包装
产品有效期为10年,申请人提供了产品有效期的报告,验证产品效期的方式为根据产品关键器件的使用寿命及该类产品在医疗机构中的使用频率来证明产品的使用期限。
申请人提交了产品运输包装验证报告,证实产品包装完整性符合设计要求。
(五)软件研究
该产品软件安全性级别为严重级别,发布版本为1,完整版本为1.0.0。申请人按照医疗器械软件注册技术审查指导原则》要求,提交了严重级别的软件研究资料和软件版本命名规则真实性声明,证实该产品软件设计开发过程规范可控,剩余风险均可接受。
申请人根据医疗器械网络安全注册技术审查指导原则》提交了网络安全研究资料,证实该产品现有网络安全风险可控,已建立网络安全应急响应计划。
(六)动物研究
提供了前代产品基于猪开展的动物试验研究报告,同时提供了申报产品与前代产品的等同性论证资料。动物试验针对猪的肺部模拟结节施行定位穿刺,记录定位精度、定位时间、定位成功率以及不良事件情况,以评价产品的有效性、安全性。试验结果证明产品应用过程安全且有效。
(七)产品符合的安全标准
GB 9706.1-2007医用电气设备第1部分:安全通用要求;
YY 0505-2012医用电气设备第1-2部分:安全通用要求并列标准:电磁兼容要求和试验;
申请人提交了相应检测报告,证实该产品符合上述安全标准要求。
三、临床评价概述
本次申报通过同品种比对路径开展临床评价,选择已上市的穿刺手术导航定位系统(注册证号:国械注准20223010624)作为对比器械。申报产品与对比器械在基本原理,适用范围、软件算法等方面相同,在控制台及脚踏开关方面存在差异(申报产品新增了触摸屏),针对差异,申请人提交了触摸屏控制效果的测试、脚踏开关功能测试及电气安全测试等相关验证确认资料,以及对比器械上市后临床文献等资料证明产品安全有效性。
四、产品受益风险判定
(一)产品受益
该产品适用于成人肺及腹部实体器官穿刺手术的导航定位。
(二)产品风险
光学跟踪系统受到光路遮挡无法导航定位的风险,通过台车设计、软件提示、用户培训等对风险进行控制;患者呼吸运动影响导航定位精度的风险,通过系统功能设计、软件提示、用户培训等对风险进行控制;机械臂以及导航定位工具无法到达预定位置的风险,通过软件提示、用户培训等对风险进行控制。
(三)受益-风险的确定
综上,申请人对当前已知及可预测风险采取了风险控制措施,经分析,用户按照使用说明书使用产品,在正常使用条件下本产品可达到预期性能。经综合评价,在当前认知水平上,认为该产品上市带来的受益大于风险,综合剩余风险可接受。
综合评价意见
申请人申请境内第三类医疗器械注册,该产品为创新医疗器械(受理号CQTS2200039),注册申报资料齐全,符合现行要求。
依据医疗器械监督管理条例》(国务院令第739号)、医疗器械注册与备案管理办法》(国家市场监督管理总局令第47号)等相关医疗器械法规和配套规章,经系统评价注册申请资料后,基于当前认知水平,认为该产品临床使用受益大于风险,注册申报资料符合现行技术审评要求,建议予以注册。
本文作者可以追加内容哦 !

