近日,clinical trials网站显示,迈威生物登记了一项Nectin-4 ADC药物9MW2821联合特瑞普利单抗与标准化疗在一线局部晚期或转移性尿路上皮癌的3期临床试验(NCT06592326)。
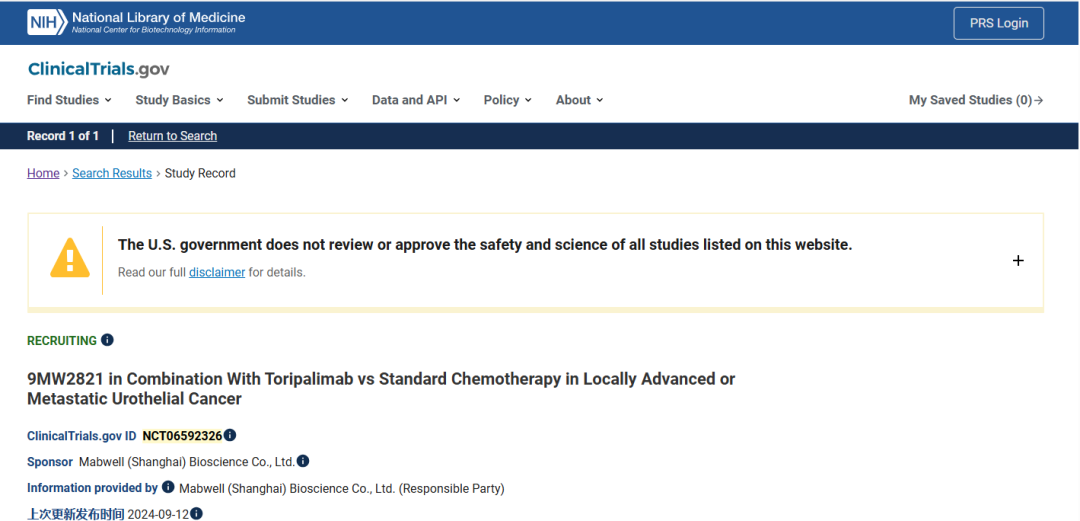
这是一项随机、对照、开放标签、多中心 3 期临床研究,旨在评估 9MW2821 联合特瑞普利单抗与标准化疗在一线局部晚期或转移性尿路上皮癌中的疗效、安全性和免疫原性。该项目临床启动时间为2024年8月,计划入组人数为460例。

该临床设计为1.25 mg/kg的9MW2821,联合君实的PD-1抗体Toripalimab抗体,对照组为化疗方案。
尿路上皮癌(UC)是最常见的膀胱癌类型。据报告,全球膀胱癌每年新发病例约57.3万例,死亡21.2万例,其中约90%患者为UC病例,转移性UC患者的5年生存率不足9%。
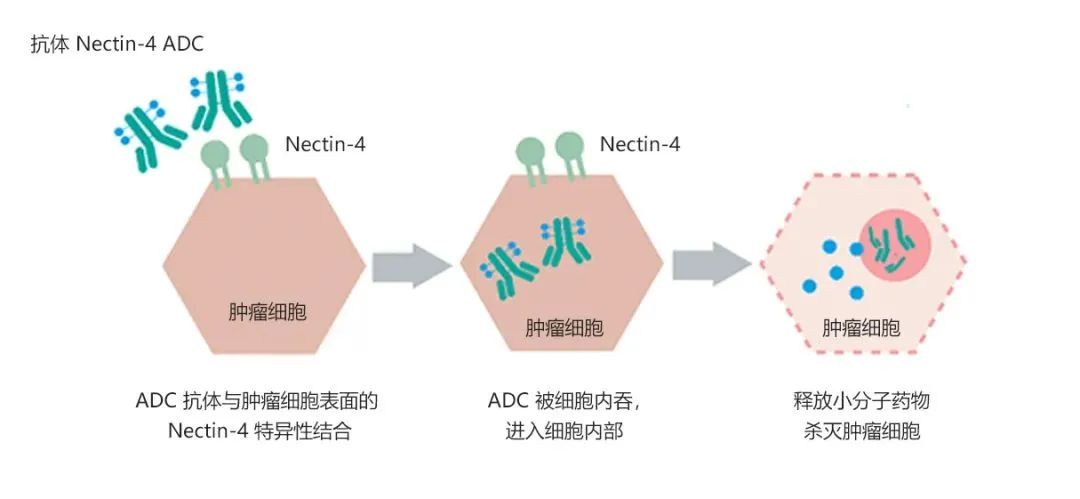
9MW2821 是迈威生物利用国际领先的 ADC 药物开发平台和自动化高通量杂交瘤抗体分子发现平台开发的一款靶向 Nectin-4 的 ADC 新药。9MW2821 具有结构均一、纯度较高、便于产业化的优点,在亲和力、内吞性质、初步的体内及体外药效活性、药物代谢性质、初步安全性等方面均显示其具有良好的成药性。临床前药理毒理结果显示,该品种在多种动物肿瘤模型中均具有良好的抑瘤效果,在食蟹猴、小鼠体内的安全性显示具有更好的治疗窗口,有望通过临床研究进一步展示其临床价值。
2024年5月,9MW2821获得FDA授予快速通道认定和孤儿药资格认定,是全球首款针对食管癌、宫颈癌和乳腺癌适应症披露临床有效性数据的靶向Nectin-4的治疗药物。
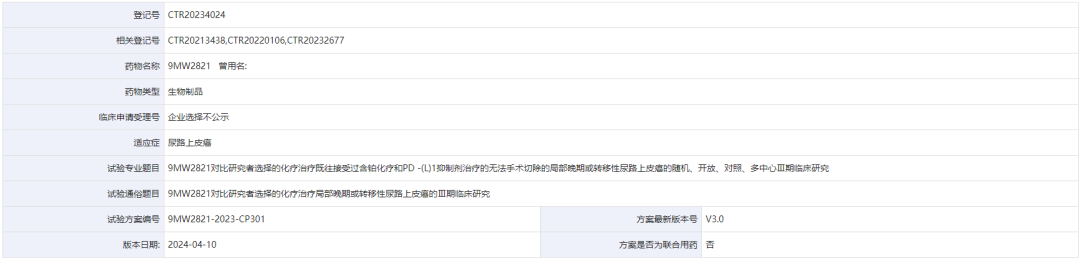
目前,9MW2821针对尿路上皮癌适应症的临床研究已进入临床III期,进度为国内第一、全球第二;针对宫颈癌及其他适应症的临床研究已进入临床II期。
小结
安斯泰来开发的Padcev(注射用维恩妥尤单抗)是目前第一个也是唯一上市的Nectin-4 ADC药物。Padcev是Seagen和安斯泰来联合开发的“同类首创”新药,以突破性疗法的身份最早在2019年12月获得FDA加速批准上市,从递交上市申请到获批仅用了2个月时间。
今年8月,NMPA官网公示,Padcev的上市申请已获得批准,用于治疗既往接受过PD-1/PD-L1抑制剂和含铂化疗治疗的局部晚期或转移性尿路上皮癌患者。

Padcev上市后的销售成绩也格外亮眼,根据安斯泰来2023年财报显示,Padcev的销售额达到556亿日元(约10.3亿美元),同比增长68.1%。上市仅4年销售额就超过10亿美元,成为“重磅炸弹”药物。根据 Evaluate Pharma 的预测,到2028年,Padcev的销售额预计将达到47亿美元。
目前,ADC靶点主要集中在HER2、TROP2和Claudin18.2等热门靶点,Nectin-4靶点的研发规模较小,但其是一个经过验证的靶点,这也给后来者在这一领域突破带来了潜在的me better机会。国内Nectin-4 ADC布局方面,进展靠前的有迈威生物9MW2821、百奥泰生物BAT8007、石药集团SYS6002、石药集团SYS6002等企业。
吉满生物推出构建Nectin-4过表达稳定细胞系、成瘤细胞系、抗体、蛋白等现货产品,充分满足药物研发需求,助力药物临床申报。
本文作者可以追加内容哦 !

