近期,Immatics在ESMO 2024上展示了正在进行的针对 MAGEA4/8 的 TCR 双特异性分子TCER IMA401 1期剂量递增试验的临床概念验证数据。
在公布临床数据的同时,Immatics也遗憾宣布,BMS已经选择了退货。双方的合作始于2021年,此前BMS支付的1.5亿美金首付款不再退回。

MAGEA4/8肽在头颈部鳞状细胞癌(HNSCC)、小细胞肺癌(SCLC)以及黑色素瘤、肉瘤亚型和其他实体瘤类型等几种实体瘤适应症中的发病率很高。
TCER IMA401 是一种新型、下一代、半衰期延长的双特异性 T 细胞接合剂,结合了针对 HLA-A*02:01 呈递的 MAGEA4/8 肽的高亲和力 TCR 结构域、低亲和力 T 细胞募集抗体和用于延长半衰期的 Fc 部分,对各种实体癌具有高靶向拷贝数。与其他双特异性抗体或细胞疗法靶向的 MAGEA4 衍生肽相比,靶肽的密度高出 5 倍以上。
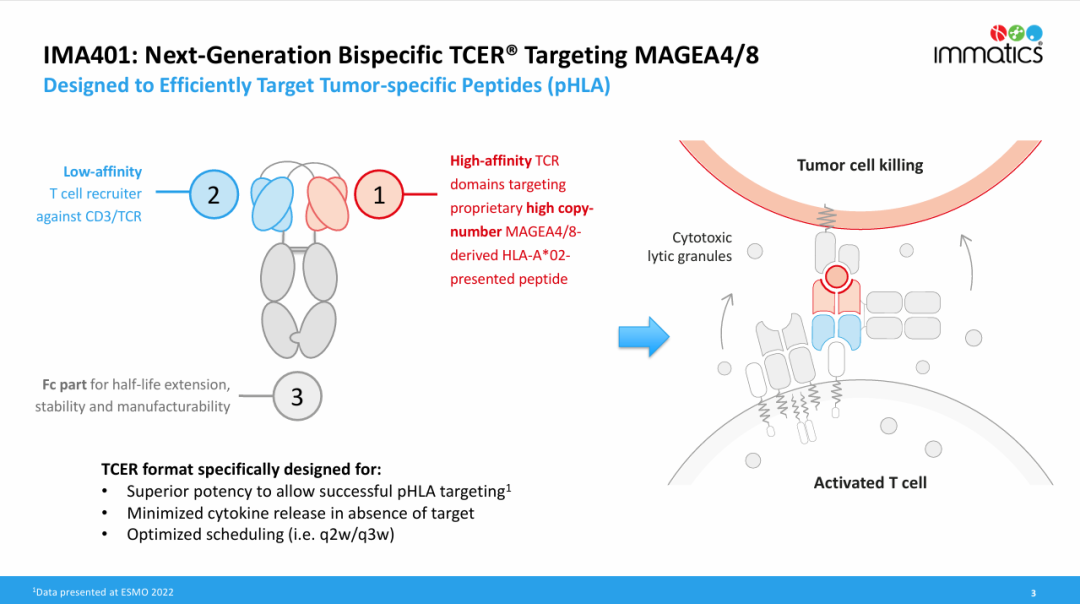
目前,IMA401 正在进行的1a/1b 期首次人体临床试验评估了其对复发/难治性实体瘤患者 (pts) 的效果。初步数据表明,该试验在大量接受过大量治疗的复发和/或难治性实体瘤患者中表现出初始抗肿瘤活性、持久的客观反应(包括持续 13 个月以上的确认反应)和可管理的耐受性。
截至 2024 年 7 月 23 日数据截止日,已有 35 名复发性和/或难治性实体瘤重度预处理患者接受了 IMA401 单药治疗,治疗剂量呈九级递增。接受治疗的患者包括16种不同实体瘤适应症的重度预处理患者。
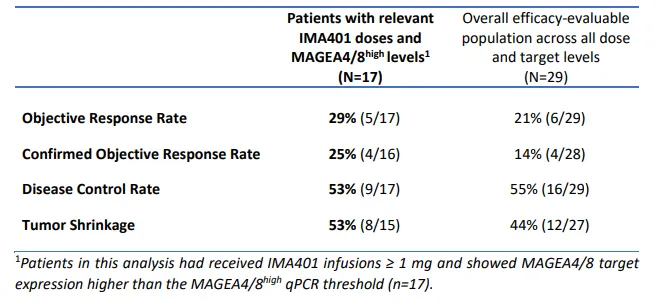
在接受相关 IMA401 剂量和 MAGEA4/8 目标水平治疗的疗效人群中,客观缓解率 (ORR) 为 29%,确认的 ORR (cORR) 为 25%,疾病控制率 (DCR) 为 53%,肿瘤缩小率为 53% 。
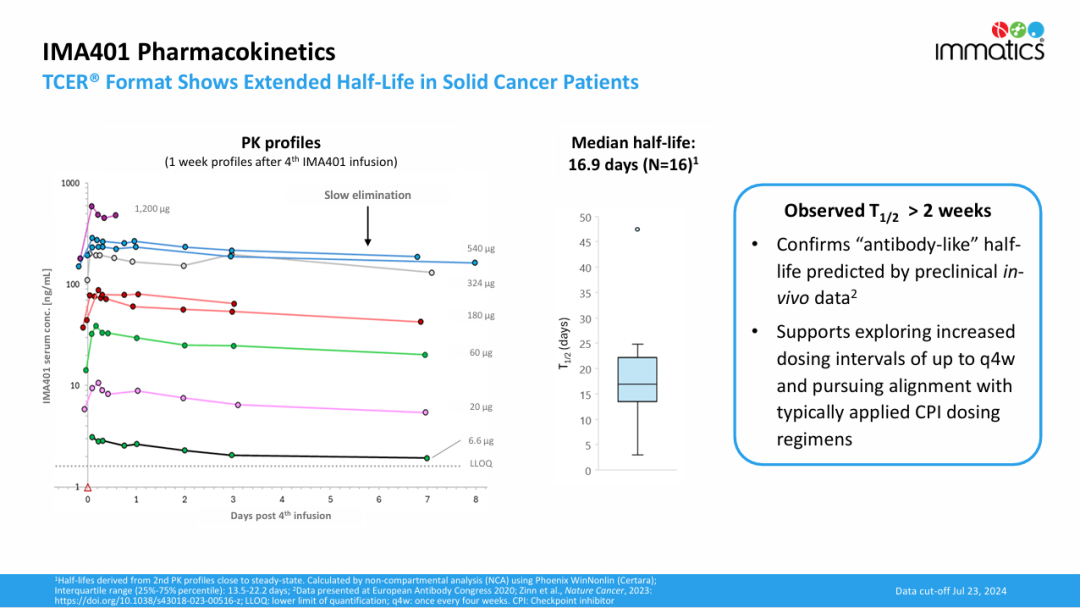
药代动力学数据表明,IMA401中位终末半衰期超过两周(16.9 天),支持目前的每两周一次的给药方案以及未来延长至每四周一次的给药方案。
安全性方面,IMA401整体显示出可管理的耐受性,最常见的治疗相关不良事件包括淋巴细胞减少、细胞因子释放综合症(CRS)和中性粒细胞减少。
根据与百时美施贵宝的协议条款,所有IMA401开发和商业化权利将回归 Immatics,此前BMS支付的1.5亿美金首付款不再退回。随着临床试验的进展,Immatics计划下一步利用该产品候选物的潜力,重点招募具有高 MAGEA4/8 靶标表达的适应症,例如肺癌和头颈癌患者,寻求优化治疗方案,并探索通过将 IMA401 与检查点抑制剂相结合为患者提供的增量临床益处。
值得一提的是,这并非BMS自2024下半年以来的首次退货,而是接连终止的第3项2021年引入的项目。
今年7月,BMS基于内部产品组合的优先级调整,与卫材终止一款靶向FR的ADC药物farletuzumab ecteribulin(MORAb-202)的全球战略合作。2021年6月,BMS与卫材就开发和销售MORAb-202达成总金额为31亿美元的合作协议。当时BMS向卫材支付了6.5亿美元的预付款,其中包括2亿美元的研发费用。合作终止后,卫材计划退还根据合作协议从BMS收到的2亿美元研发费用中未使用部分,并将其余部分记录为其他收入。
8月,BMS将TIGIT双特异性抗体项目的所有权归还给Agenus,该项目正处于针对实体瘤的早期试验阶段。这笔交易也是在2021年,当时以2亿美元的预付款达成的。吉利德和罗氏都有TIGIT项目,但罗氏于7月4日宣布II/III期SKYSCRAPER-06研究失败后取消了对该候选药物的临床试验
此前,即4月25日,BMS在其2024年第一季度的财报中表示,将实施一项全面的“战略生产力计划”,该计划包括组织管理结构重组,优化产品管线。
BMS计划在2025年底前,在全球范围内裁撤大约2200个工作岗位,占这家公司总员工的6.5%。其中,近900人将在6月开启的调整中离开。这场大裁员旨在到2025年底为公司节省约15亿美元,将该资金会直接投入到“前景看好”的管线项目。
本文作者可以追加内容哦 !

