9月25日,CDE官网显示,乐普生物的 EGFR ADC 维贝柯妥塔单抗(MRG003)申报上市,首发适应症为既往经至少二线系统化疗和 PD-1/PD-L1 抑制剂治疗失败的复发/转移性鼻咽癌患者。

目前,国内尚没有 EGFR 靶向 ADC 获批上市。乐普的 MRG003 是国内首个申报上市的 EGFR ADC。

鼻咽癌是起源于鼻咽黏膜的上皮性癌,常常发生于鼻咽部咽隐窝处,是我国常见的恶性肿瘤之一。据统计,鼻咽癌发病具有明显的地区和人种差异,多见于黄种人;70%以上新发病例出现在东亚及东南亚,中国占全球鼻咽癌病例近半数。
此外,R/M NPC患者的生存结果极差,中位生存期(OS)约为20个月。当前,针对R/M NPC患者的主要治疗手段为系统化疗,然而在含铂治疗方案失败后,针对这类患者的二线或三线治疗可选的治疗方案和治疗效果仍然有限。
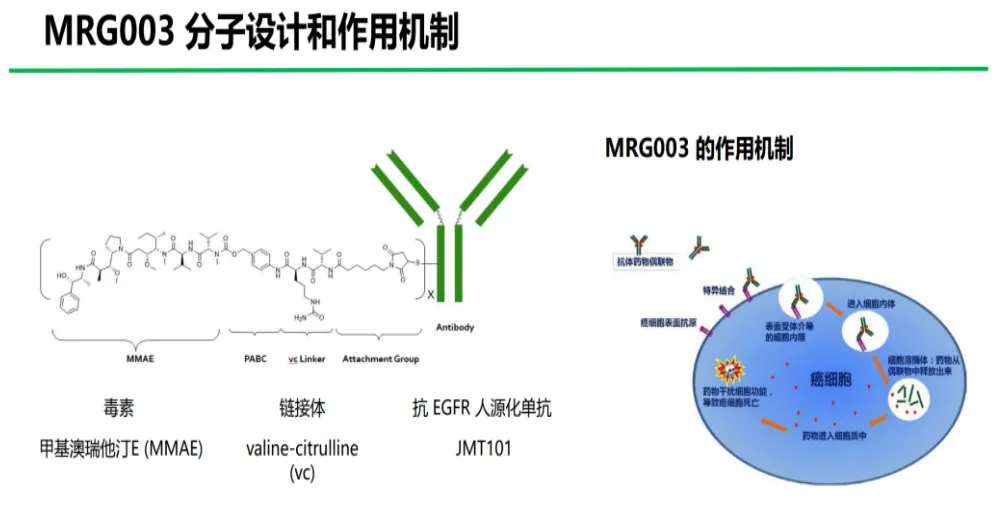
MRG003 是一种由 EGFR 靶向单抗与强效的微管抑制有效载荷 MMAE 分子通过 vc 链接子偶联而成的 ADC。它以高亲和力特异性地结合肿瘤细胞表面的 EGFR,通过内吞进入肿瘤细胞后释放强效的有效载荷,从而导致肿瘤细胞死亡。
2023 ESMO会议上,乐普生物公布了MG003治疗鼻咽癌的IIa期临床最新数据,共计入组61例鼻咽癌患者。截至2023年3月15日,对57位已经接受过PD-(L)1抑制剂和含铂化疗的鼻咽癌患者进行了疗效评估。该研究调查了两种剂量水平的 MRG003 (2.0 或 2.3 mg/kg,Q3W),以确定最佳剂量。
结果显示,整体的客观反应率(ORR)为47.4%,疾病控制率(DCR)为79.0%。
在2.0mg/kg剂量组中,28位患者的ORR为39.3%,DCR为71.4%;
在2.3mg/kg剂量组中,29位患者的ORR为55.2%,DCR为86.2%。
安全性方面,研究人员评估的最常见治疗相关不良反应 (TRAE) 是皮疹 、瘙痒 、贫血 和脱发;大多数 TRAE 为 1 级或 2 级。治疗相关严重不良事件 (SAE) 的发生率为 11.5%。由于 TRAE 导致的剂量减少率为 13.1%,3 名患者停止治疗。未观察到与治疗相关的死亡。
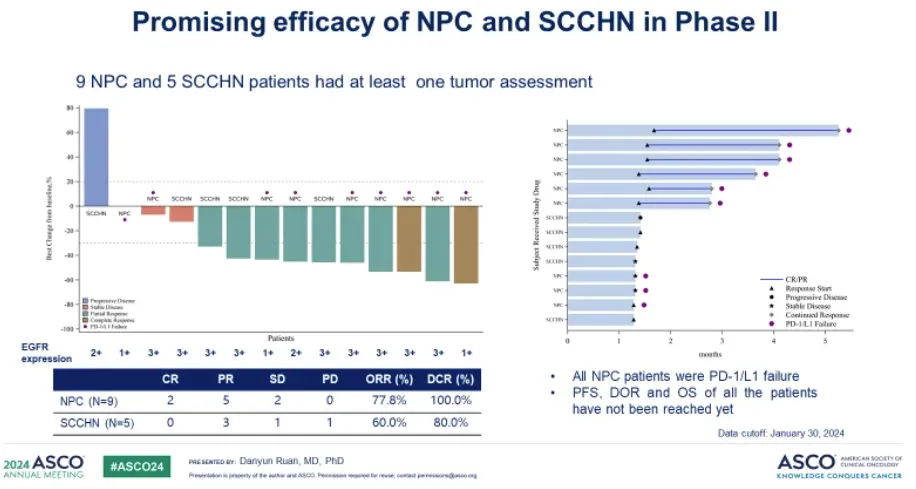
值得一提的是,除了单药治疗复发/转移性鼻咽癌外,乐普生物也在探索 MRG003 与 PD-1 抑制剂普特利单抗联合治疗鼻咽癌患者的效果。今年ASCO会议上,乐普生物公布了PD-1抗体普特利单抗+MRG003联合治疗的1/2期临床最新数据,其中二期临床部分,9例经PD-1+化疗一线治疗后进展的EGFR阳性鼻咽癌患者,ORR为77.8%(7/9),DCR为100%(9/9)。
此前MRG003 治疗复发性或转移性鼻咽癌曾获得 CDE 授予的突破性治疗药物品种、拟优先审评资格,这意味着该药有望加速在中国获批。在海外,MRG003已获FDA授予孤儿药资格、快速通道资格,用于治疗复发性或转移性鼻咽癌(R/M NPC)。2024年8月5日,乐普生物宣布MRG003再获FDA突破疗法认证。

图源:乐普生物官网
截止发稿,乐普生物股票上涨超2%!
本文作者可以追加内容哦 !

