重磅:中源协和参股公司纳合源生物科技(天津)有限公司研发的CAR-T细胞治疗产品基奥仑赛注射液(商品名:源瑞达),于2024年9月26日获得中国国家药品监督管理局(NMPA)的上市申请受理。该药品通过基因修饰技术将靶向CD19的嵌合抗原受体(CAR)表达于T细胞表面而制备成的自体T细胞免疫治疗产品,用于治疗成人复发或难治性B细胞急性淋巴细胞白血病(r/r B-ALL)。
此前,2022年已经通过了优先审评,并且2023年被纳入附条件批准上市。据公司公开售价一阵高达100万元,属于公司里程碑重磅产品。
急性B淋巴细胞白血病(B-ALL)是成人最常见的急性白血病之一,疾病恶性程度高,容易复发,再治疗时预后往往不尽人意,患者的长期生存一直成为困扰白血病领域数十年的难题。2023年11月7日,由道彤Family企业——合源生物自主原研的纳基奥仑赛注射液在中国获批用于治疗复发/难治(R/R) B-ALL,作为我国首款针对白血病领域的嵌合抗原受体T(CAR-T)细胞产品,它为患者带来突破性的治疗选择。为了进一步推动CAR-T在白血病治疗中多学科的全程综合管理,中国临床肿瘤学会(CSCO)白血病专家委员会携手中国医师协会血液科医师分会和中华医学会血液学分会共同发布《纳基奥仑赛注射液临床应用指导原则》。
纳基奥仑赛注射液的关键性注册临床研究HY001201研究显示,治疗后3个月内的总缓解率(ORR)达到82.1%,3个月时的ORR为64.1%。中位随访8个月时,所有输注患者的中位缓解持续时间(DOR)、无复发生存(RFS)和总生存(OS)均未达到。预计12个月的DOR率、RFS率与OS率分别为80%、80%和85.6%。安全性方面,≥3级细胞因子释放综合征(CRS)和免疫效应细胞相关神经毒性综合征(ICANS)的发生率分别为10.3%和7.7%,所有患者经对症处理后均恢复,未发生因CRS、ICANS所致的死亡。
纳基奥仑赛注射液的推荐剂量为0.5×10^8^ CAR-T活细胞,剂量范围是0.25×10^8^~0.5×10^8^ CAR-T活细胞(20%,即0.2×10^8^~0.6×10^8^ CAR-T活细胞)。输注前和输注后恢复期间,医疗机构应备有至少2次治疗剂量的托珠单抗和完善的急救设备及药物。输注过程中应使用带滤网的双头输液器建立静脉通路,并在细胞输注前用0.9% NaCl溶液冲管。输注后患者需留院监测至少2周,并在接下来的2周内生活在医疗机构附近继续观察。
此外,纳基奥仑赛注射液治疗的患者应进行长期随访,包括定期监测患者的疾病状态、评估纳基奥仑赛注射液治疗的远期效应等。对于HBV慢性感染者,即使在CAR-T治疗中预防性使用核苷(酸)类似物(NA),仍有可能发生HBV再激活;预防性使用NA可能会降低CAR-T治疗相关的HBV再激活风险。
值得注意的是,CAR-T细胞治疗产品的价格通常较高,但已有企业尝试通过按疗效付费的方式来提高药品的可及性和可负担性。例如,复星凯特推出的CAR-T药品阿基仑赛注射液(商品名:奕凯达)的按疗效价值支付计划,若患者未能达到完全缓解(CR),将获得最高60万元的费用返还。这种模式可能会为其他高价药品的支付提供新的思路。
国内已有6款CAR-T产品获批上市。
一,复星凯特的阿基仑赛注射液(奕凯达)
120万元/针。
适应症:用于治疗既往接受二线或以上系统性治疗后复发或难治性大B细胞淋巴瘤成人患者
二,药明巨诺的瑞基奥仑赛注射液(倍诺达)
129万元/针。
适应症:本品用于治疗:经过二线或以上系统性治疗后成人患者的复发或难治性大B细胞淋巴瘤。经过二线或以上系统性治疗的成人难治性或24个月内复发的滤泡性淋巴瘤。
三,信达生物与驯鹿生物合作研发的伊基奥仑赛注射液(福可苏)
116.6万元/针。
适应症:用于治疗既往经过至少3线治疗后进展(至少使用过一种蛋白酶体抑制剂及免疫调节剂)的复发或难治性多发性骨髓瘤(RRMM)成人患者。
四,科济生物/华东医药合作研发的泽沃基奥仑赛注射液批准(赛恺泽)
115万元/针。
适应症:用于治疗成人复发或难治性患者先前在至少 3 线治疗(包括蛋白酶体抑制剂和免疫调节剂)后出现进展的多发性骨髓瘤。
五,合源生物科技(天津)的纳基奥仑赛注射液(源瑞达)
99.9万元/针。
适应症:用于成年复发或难治B细胞急性淋巴细胞白血病(r/r B-ALL)患者。
六,传奇生物的西达基奥仑赛注射液(卡卫荻)
美国定价:46.5万美元(约人民币330万元)/针。
中国定价:尚未公布。
适应症:用于治疗复发/难治性多发性骨髓瘤
以上,治疗大B细胞淋巴瘤有2个 产品,治疗多发性骨髓瘤有3个产品,治疗白血病(r/r B-ALL)有一个产品。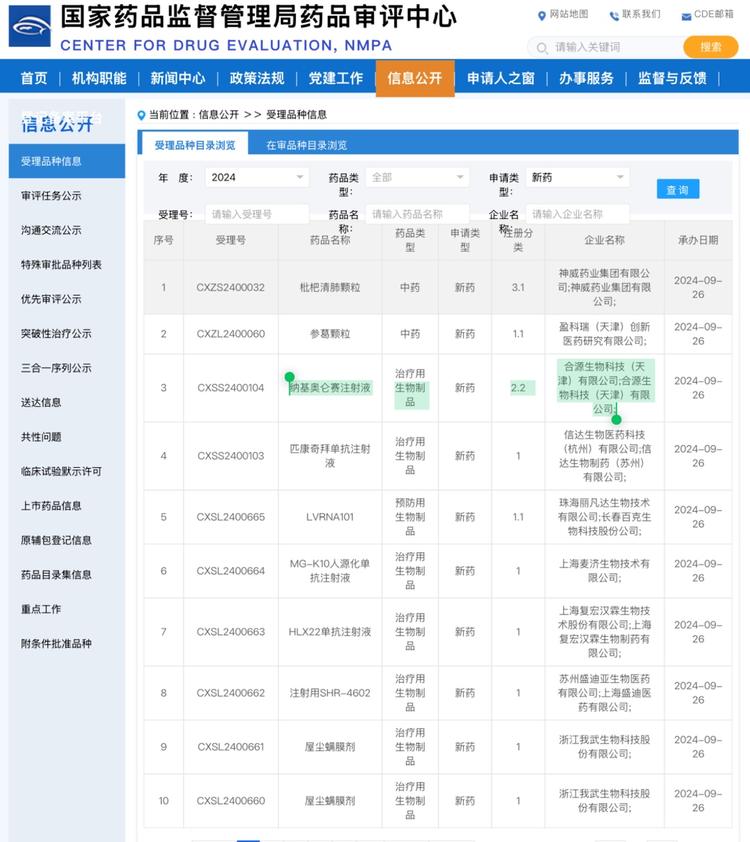
本文作者可以追加内容哦 !

