10月7日,2024 年诺贝尔生理学或医学奖被授予了miRNA(小分子核糖核酸)的发现者麻省大学医学院自然科学教授Victor Ambros和波士顿哈佛医学院的遗传学教授Gary Ruvkun。以表彰他们“发现miRNA及其在转录后基因调控中的作用”。
在诺贝尔奖的光环之下,miRNA赛道或将迎来前所未有的蓬勃发展期。

【奇迹发现】miRNA从线虫到诺贝尔奖的奇妙之旅
故事发生在一次偶然的科学探索中。1993年,Victor Ambros博士正专心致志地探索着秀丽隐杆线虫,意外发现了第一个miRNA lin-4 [1]。他发现,当线虫体内的lin-4基因发生突变,其发育会异常停滞在幼虫阶段。这一异常现象激发了Ambros博士的好奇心,他深入探究lin-4基因的奥秘。
在Horvitz的实验室,Ambros博士遇到了他的得力搭档Ruvkun博士。他们利用分子克隆技术,鉴定了两个与线虫发育时间相关的关键基因:lin-4和lin-14。他们发现,lin-4转录成的22核苷酸长RNA能直接与lin-14的mRNA的3'非翻译区配对,调控其表达。这一发现颠覆了RNA的传统角色,证明了RNA在基因调控中的关键作用。然而,Ambros博士的这项开创性工作并未获得哈佛大学的赏识,最终遗憾离职。
但真理的光芒无法被掩盖。7年后,Ruvkun博士发现了第二个miRNA——let-7[2],它同样通过抑制特定mRNA表达调控发育,且在果蝇、斑马鱼、海胆和人类等多种生物中保守表达,这些发现不仅推动了miRNA领域的研究,也为未来的治疗方法提供了新思路。
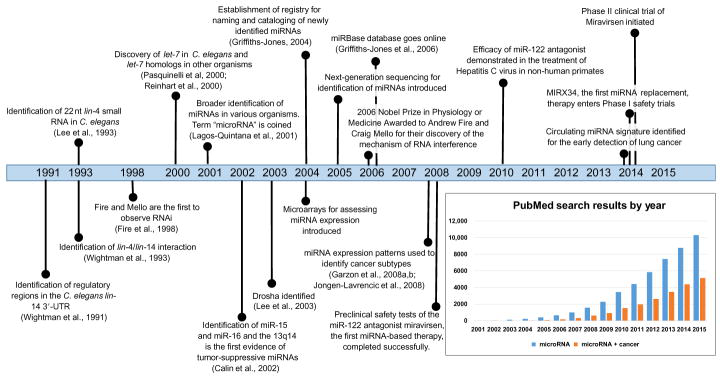
从发现第一个miRNA到现在已有30多个年,miRNA的研究已进入了井喷时代。根据miRBase的最新数据统计显示,当前已发现的人类miRNA前体有1982条,成熟miRNA有2694条。这些遍布于生命体各个角落的微小RNA分子,以其独特的调控机制在基因表达的精准调控过程中发挥着举足轻重的关键作用。
【生命密码】miRNA精准调控基因的作用机制
miRNA通过其种子序列(通常位于5'端的2-8个核苷酸)与靶mRNA的3'UTR进行不完全互补配对,实现对其表达的调控。根据互补程度的不同,miRNA的调控机制可分为两种主要类型:
翻译抑制:在大多数情况下,miRNA通过其种子序列(通常位于5'端的2-8个核苷酸)与靶mRNA的3'非翻译区(3'UTR)进行不完全互补配对。这种不完全互补使得miRNA能够结合到靶mRNA上,但并不导致mRNA的降解。相反,它阻止了核糖体对mRNA的翻译过程,从而抑制了蛋白质的合成。
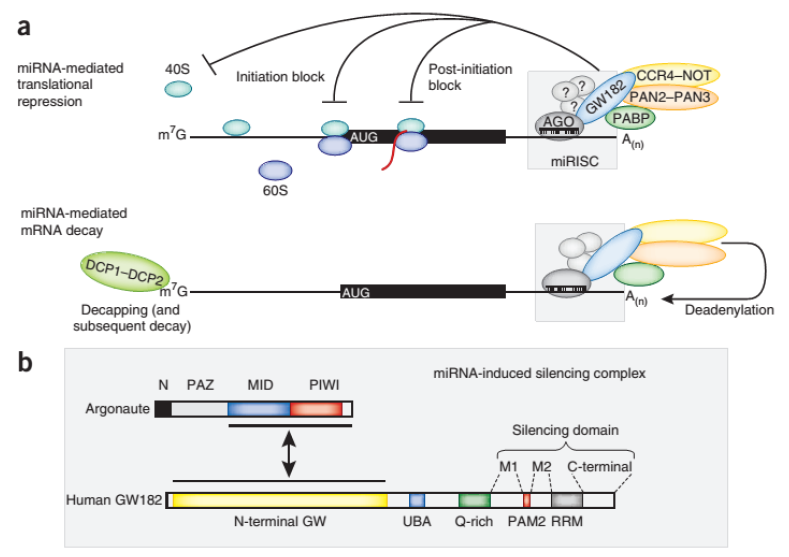
miRNA抑制转录机制(a)及AGO蛋白和GW182蛋白结构(b)[4]
mRNA降解:在某些情况下,miRNA与靶mRNA的互补程度较高,这种高互补性使得RISC复合体能够招募核酸外切酶或内切酶等降解酶类,从而抑制靶基因的表达。
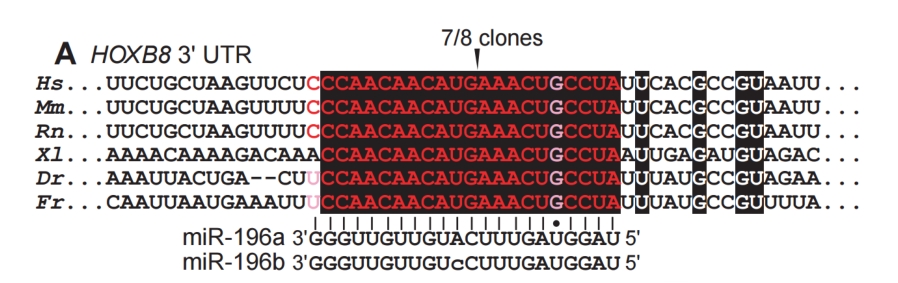
如上图miR-196 与HOXB8有近乎完全的匹配,导致了 mRNA 切割的发生。切割之后的 mRNA 会被降解。
值得注意的是,miRNA的调控作用具有高度的特异性和灵活性。由于miRNA与靶mRNA的互补配对允许一定程度的错配,因此一个miRNA可以调控多个靶基因的表达;同时,一个靶基因也可能受到多个miRNA的共同调控。这种复杂的调控网络确保了生物体在各种环境条件下能够维持内环境的稳定。
【药物前沿】miRNA在药物开发中的多元化应用实例
miRNA在药物研发中的应用是一个快速发展的领域,它涉及到利用miRNA的调控机制来开发新的治疗方法。以下是一些miRNA在药物研发中的具体应用实例:
1.肿瘤治疗:作为一种关键的基因表达调控因子,miRNA通过精细调节细胞内基因表达水平,对肿瘤细胞的生长、增殖、侵袭和转移等过程产生深远影响。具体而言,科学家们已经探索了多种基于miRNA的肿瘤治疗策略。

一方面,针对在肿瘤中异常高表达、具有原癌基因作用的miRNA,如miR-155,Viridian Therapeutics公司成功开发了anti-miR药物MRG-106(Cobomarsen),并在皮肤T细胞淋巴瘤的临床试验中初步验证了其抑制肿瘤生长的效果。另一方面,对于在肿瘤中表达下调的抑癌性miRNA,如miR-34a,通过开发其模拟物并恢复其表达水平,也为肿瘤治疗提供了新的思路。此外,考虑到miRNA分子小且不稳定,科学家们还致力于开发高效的miRNA靶向递送系统,如利用纳米金刚石等载体,将miR-203等抑癌miRNA精准递送至肿瘤细胞,显著增强了治疗效果。更令人振奋的是,miRNA还能与其他治疗手段如化疗药物联合使用,形成综合治疗方案,如miR-634模拟物与顺铂的联用,显著增强了抗肿瘤作用,同时可能减少副作用。
2.病毒性疾病:miRNA也显示出在治疗病毒性疾病,如丙型肝炎(HCV)的潜力。例如,Miravirsen(anti-miR)是Santaris自主开发的全球第一款miRNA抑制剂药物,它通过抑制miR-122来治疗HCV感染。miR-122 是肝特异性表达的一种 miRNA,它在抵抗 HBV 中有重要作用。miR-122 可以直接结合到 HBV 的前基因组 RNA 上,抑制 HBV 的复制与翻译[8]。然而,miR-122 却能结合到 HCV RNA 的 5’-UTR,促进 HCV 的增殖[9]。
3. 心血管疾病:Cardior Pharmaceuticals开发的CDR132L是一种基于寡核苷酸的miRNA抑制剂,它通过阻断miR-132来改善心脏功能,并正在进行心力衰竭的临床试验。
4.神经系统疾病:miRNA在调节神经系统功能中起关键作用,因此它们可能成为治疗如阿尔茨海默病和帕金森病等疾病的潜在靶点。Mao等人[10]发现在小鼠皮层发生过程中,miR-17 可以调节神经前体细胞的增殖和分化。另外,他们还发现:在神经炎症性环境下,miR-17-92 可以促进移植的神经干细胞的分化[11]。
5.自身免疫性疾病:miRNA也参与自身免疫病的发病过程,通过调控免疫细胞的分化和功能来影响疾病的进展。来自上海交通大学医学院、耶鲁大学医学院、美国MedImmune LLC公司等机构的研究人员证实,一种叫做miR-125a的小分子RNA可靶向效应器程序来稳定调节性T细胞(Treg)介导的免疫稳态[12]。因此,针对自身免疫病相关的miRNA进行干预,可能成为一种新的治疗策略。
6.代谢疾病:miR-7、miR-375、MiR-216、miR-217及miR-124a均被报道在胰岛/胰腺中特异性表达。如miR-323-3p通过抑制AdipoR1/AMPK/SIRT-1通路,调控MIN6细胞的的生长增殖、有丝分裂以及胰岛素分泌[13]。
7.疫苗开发:miRNA还可以用于疫苗开发,例如在活病毒疫苗中加入miRNA响应元件(MREs)来减毒,通过这种方式,让病毒无法在表达与插入的MRE结合的miRNA的细胞中复制,从而提高疫苗的安全性。
8.疾病诊断:特定miRNA的表达水平可以作为疾病发生的生物标志物,为疾病的早期诊断提供有力依据。如通过监测特定miRNA的表达水平,如Let-7、hsa-miR-23b等,可以实现肺癌的早期检测。
这些例子展示了miRNA在药物研发中的多样性和潜力。随着研究的深入和技术的进步,预计miRNA药物将在未来的临床治疗中发挥更大的作用。
【创新引擎】美迪西核酸药物研发服务平台:核酸药物的梦想加速器
随着miRNA研究的深入,核酸药物的开发迎来了新的发展机遇。美迪西核酸药物研发平台正全速赋能创新药物的研发进程。作为集成了药物发现、生产和临床前研究的一体化综合性平台,美迪西核酸药物研发平台可提供核酸药物发现、筛选及临床前研究服务,精准满足行业对于前沿创新核酸药物的迫切需求。
值得一提的是,今年7月,美迪西与恒瑞医药携手达成了关于核酸药物等临床前评价的战略合作协议。这一里程碑式的合作,不仅彰显了美迪西在核酸药物研发领域的深厚实力与广泛影响力,更为双方共同探索新药研发的广阔天地奠定了坚实基础。
Victor Ambros博士和Gary Ruvkun博士荣获诺贝尔奖,不仅是他们个人智慧与不懈努力的结晶,更是全人类科学在科学探索征途上共同取得的荣耀。miRNA的发现为药物研发领域带来了革命性的突破与变革。在这个充满挑战与机遇的新时代,美迪西愿与全球新药研发的同仁们并肩作战,共同推动核酸药物的发展迈向新的高度。
参考文献:
1.Lee RC, Feinbaum RL, Ambros V. The C. elegans heterochronic gene lin-4 encodes small RNAs with antisense complementarity to lin-14.Cell. 1993 Dec 3; 75(5):843-54.
2.Amy E. Pasquinelli,Brenda J. Reinhart,Frank Slack,Mark Q. Martindale,Gary Ruvkun. Conservation of the sequence and temporal expression of let-7 heterochronic regulatory RNA. Nature. 2000 Nov 2.
3.Weiss CN, Ito K. A Macro View of MicroRNAs: The Discovery of MicroRNAs and Their Role in Hematopoiesis and Hematologic Disease. Int Rev Cell Mol Biol. 2017;334:99-175. doi:10.1016/bs.ircmb.2017.03.007
4. Fabian MR, Sonenberg N: The mechanics of miRNA-mediated gene silencing: a look under the hood of miRISC. Nat Struct Mol Biol 2012, 19:586-593.
5.Yekta S, Shih IH, Bartel DP: MicroRNA-directed cleavage of HOXB8 mRNA. Science 2004, 304:594-596.
6.Bartel DP, Chen CZ: Micromanagers of gene expression: the potentially widespread influence of metazoan microRNAs. Nat Rev Genet 2004, 5:396-400.
5.Esquela-Kerscher A, Slack FJ: Oncomirs - microRNAs with a role in cancer. Nat Rev Cancer 2006, 6:259-269.
6.Chen Y, Shen A, Rider PJ, Yu Y, Wu K, Mu Y, Hao Q, Liu Y, Gong H, Zhu Y, et al: A liver-specific microRNA binds to a highly conserved RNA sequence of hepatitis B virus and negatively regulates viral gene expression and replication. FASEB J 2011, 25:4511-4521.
7.Jopling CL, Schutz S, Sarnow P: Position-dependent function for a tandem microRNA miR-122-binding site located in the hepatitis C virus RNA genome. Cell Host Microbe 2008, 4:77-85.
8.Schetter AJ, Leung SY, Sohn JJ, Zanetti KA, Bowman ED, Yanaihara N, Yuen ST, Chan TL,Kwong DL, Au GK, et al: MicroRNA expression profiles associated with prognosis and therapeutic outcome in colon adenocarcinoma. JAMA 2008, 299:425-436.
9.Degagne E, Pandurangan A, Bandhuvula P, Kumar A, Eltanawy A, Zhang M, Yoshinaga Y,Nefedov M, de Jong PJ, Fong LG, et al: Sphingosine-1-phosphate lyase downregulation promotes colon carcinogenesis through STAT3-activated microRNAs. J Clin Invest 2014, 124:5368-5384.
10.Mao S, Li H, Sun Q, Zen K, Zhang CY, Li L: miR-17 regulates the proliferation and differentiation of the neural precursor cells during mouse corticogenesis. FEBS J 2014,281:1144-1158.
11.Mao S, Li X, Wang J, Ding X, Zhang C, Li L: miR-17-92 facilitates neuronal differentiation of transplanted neural stem/precursor cells under neuroinflammatory conditions. J Neuroinflammation 2016, 13:208.
12.Pan W, Zhu S, Dai D, et al. MiR-125a targets effector programs to stabilize Treg-mediated immune homeostasis[J]. Nature communications, 2015, 6.
13.Wang, Xiaojuan,Li, Jun,Tang, Wei,等.Adiponectin receptor 1-mediated micro RNA-323-3p regulates functions of the MIN6 cell line via the AMP-activated protein kinase/sirtuin-1 pathway[J].The Journal of international medical research.2018,46(5).
本文作者可以追加内容哦 !

