中国新型TCR-T细胞疗法TAEST16001获美国FDA新药申请批准,更多的TCR-T疗法为肉瘤、肝癌、宫颈癌、等带来生存希望
近期国际知名期刊《Cell Rep
Med》报道了我国首个获美国FDA研究性新药申请批准(IND)的TCR-T细胞产品——TAEST16001的Ⅰ期临床研究成果,为过继性T细胞免疫疗法在晚期软组织肉瘤的临床转化中迈出了关键一步,也有望成为全球第二款上市的针对实体瘤的TCR-T细胞产品!
我国首款TCR-T产品IND获批,剑指滑膜肉瘤

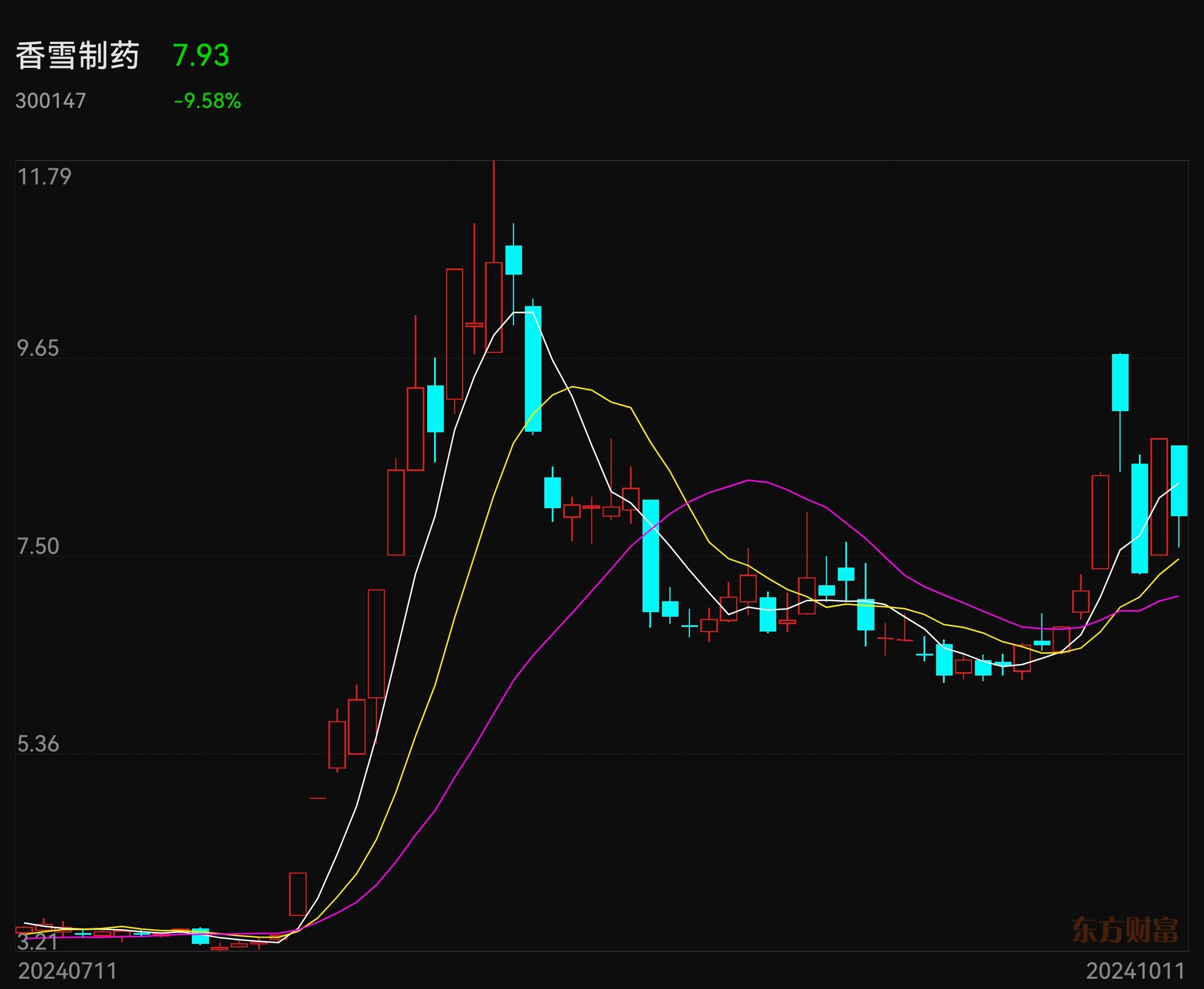
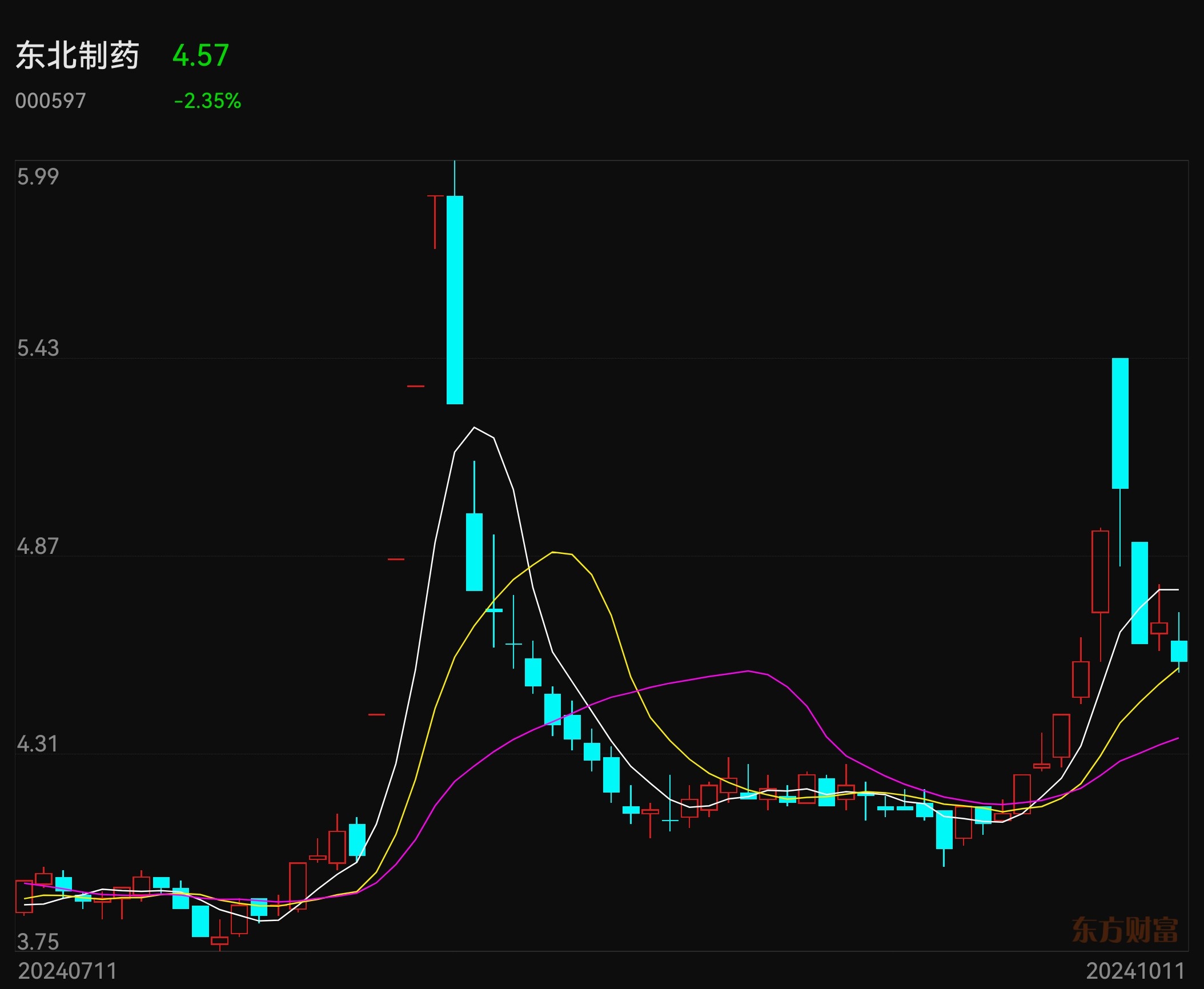
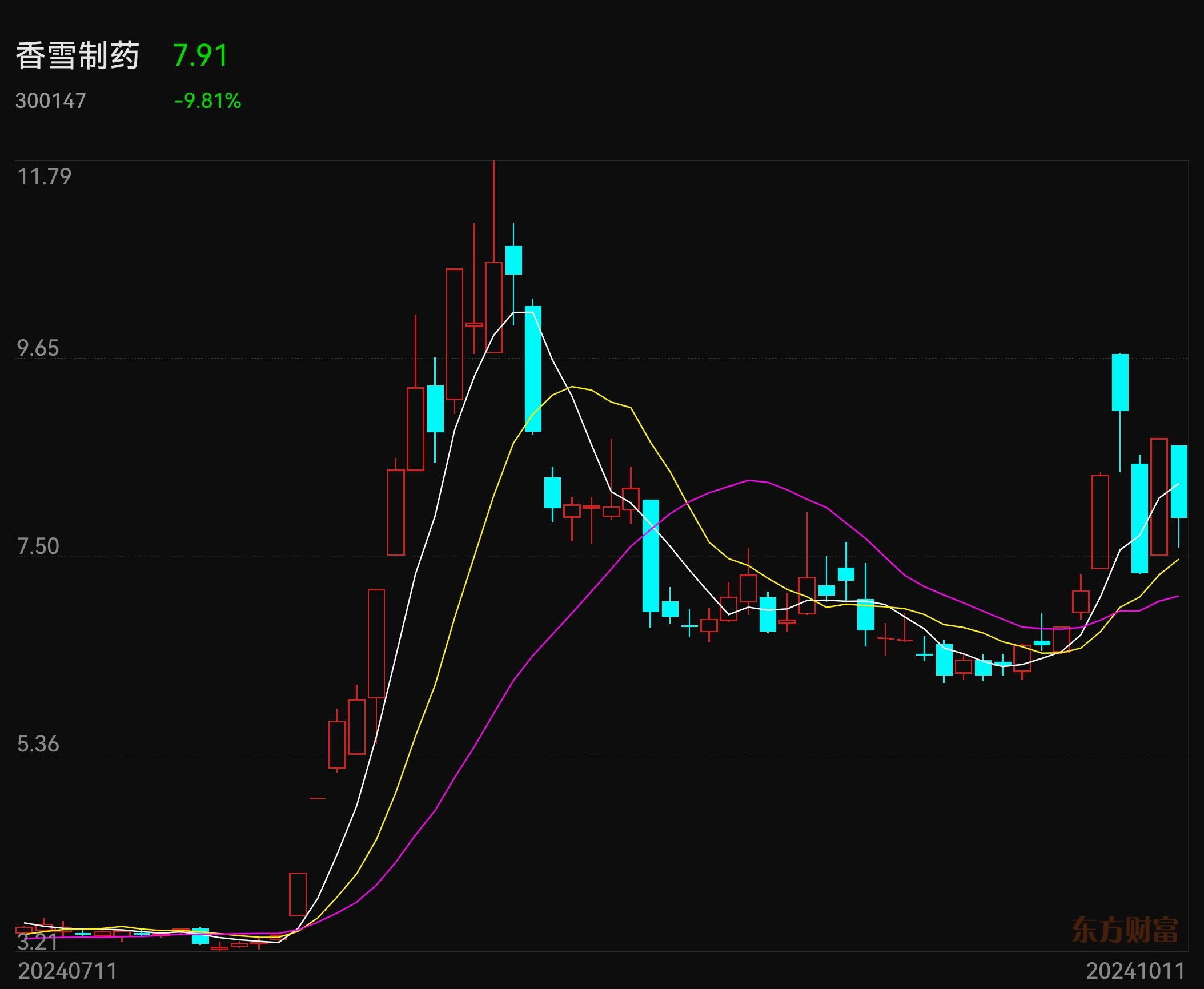
国泰君安、海通证券连续涨停板,一是合并重组,更是补涨。香雪制药申请CDE的I类会议重磅利好可能在近日发布,可能三期临床试验与附条件上市同时进行。昨天香雪制药20cm涨停板了,今天开盘迅速跌10%,这可能与今天没有公告CDE一类会议沟通结果有关。这个一类会议结果公告应该不迟于下周二,因为申请后30个工作日就是今天10月11日。欢迎大家交流指正。$国泰君安(SH601211)$ $香雪制药(SZ300147)$ $海通证券(SH600837)$ #高盛中国董事长:A股最好是慢牛市# #券商“航母”将诞生,国泰、海通怎么走?# #实盘记录#
中信证券与中金公司已上报SFISF,国泰君安与海通证券暂无消息。
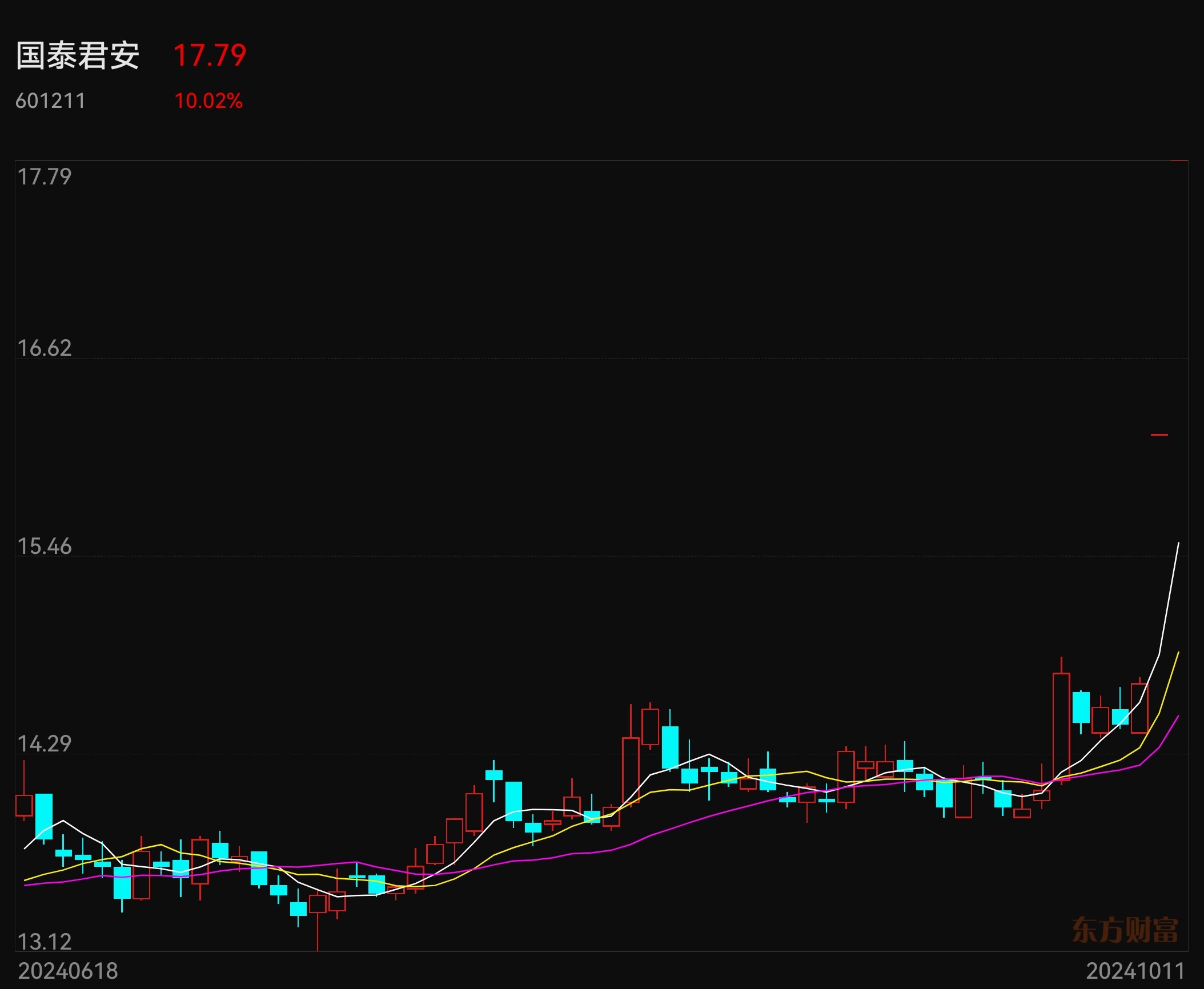
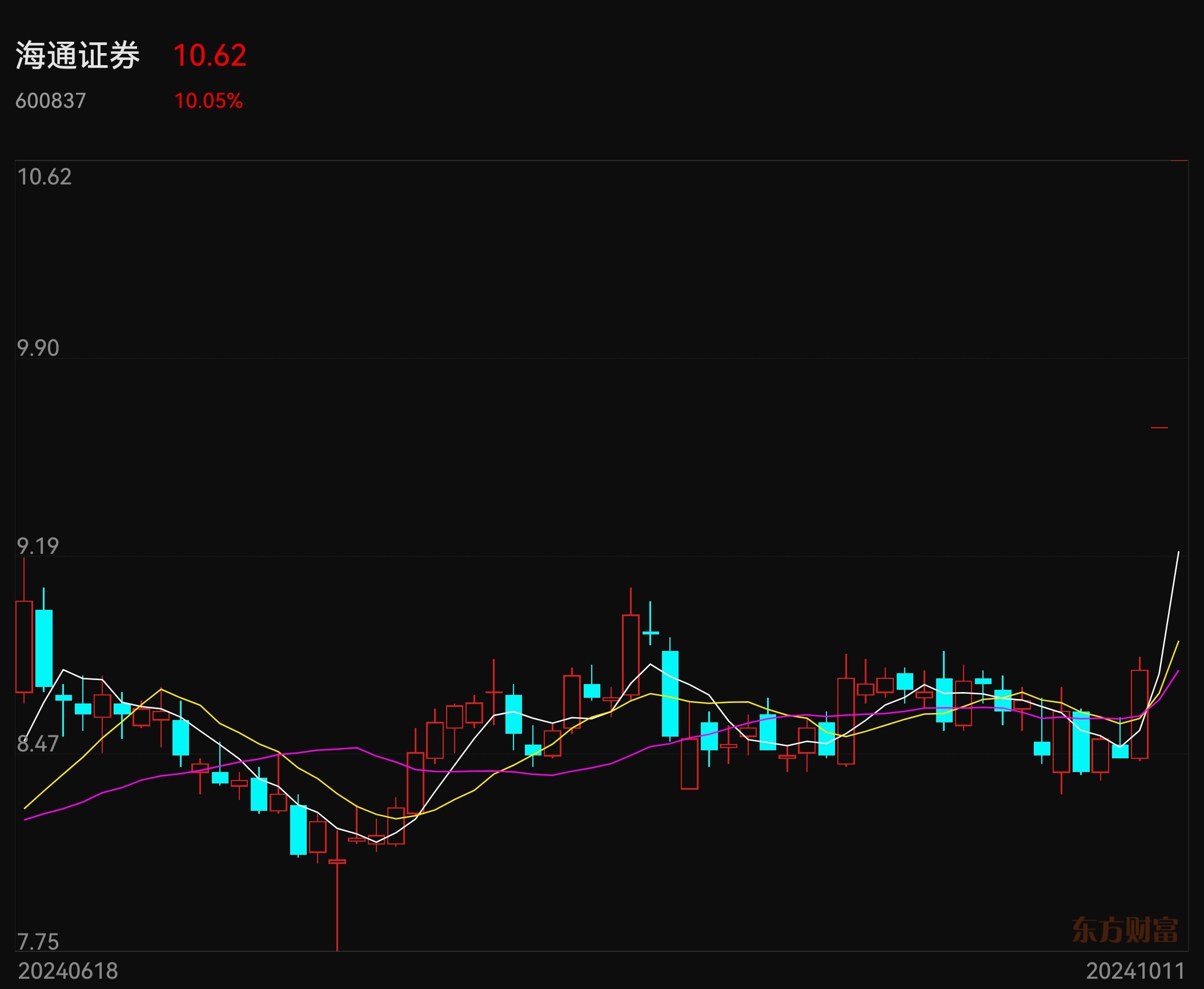
国泰君安、海通证券合并重组预案出炉 复牌双双股价飙升
- 国泰君安 10.02%
- 海通证券 10.05%
10月10日,备受市场关注的“航母级券商”合并重组双方,在9日晚间披露重组预案后,双双复牌。截至10日9点20分,国泰君安(601211.SH、02611.HK)、海通证券(600837.SH、06837.HK)A股股价封住一字涨停板,国泰君安H股股价涨幅达到106%,海通证券股价涨幅达到134%。
$国泰君安(SH601211)$$海通证券(SH600837)$$中信证券(SH600030)$
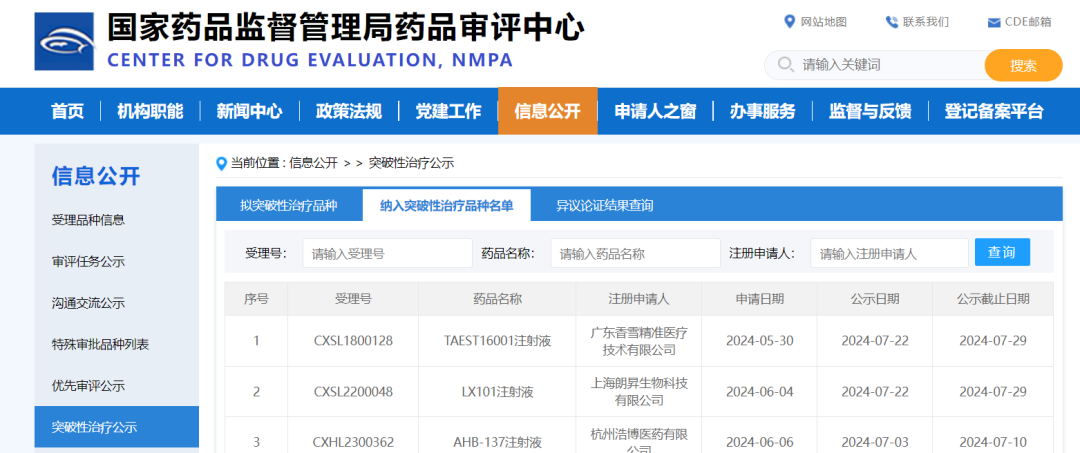
香雪制药TCR-T细胞治疗新药纳入突破性治疗品种,广州生物医药细胞治疗产业再迎新突破
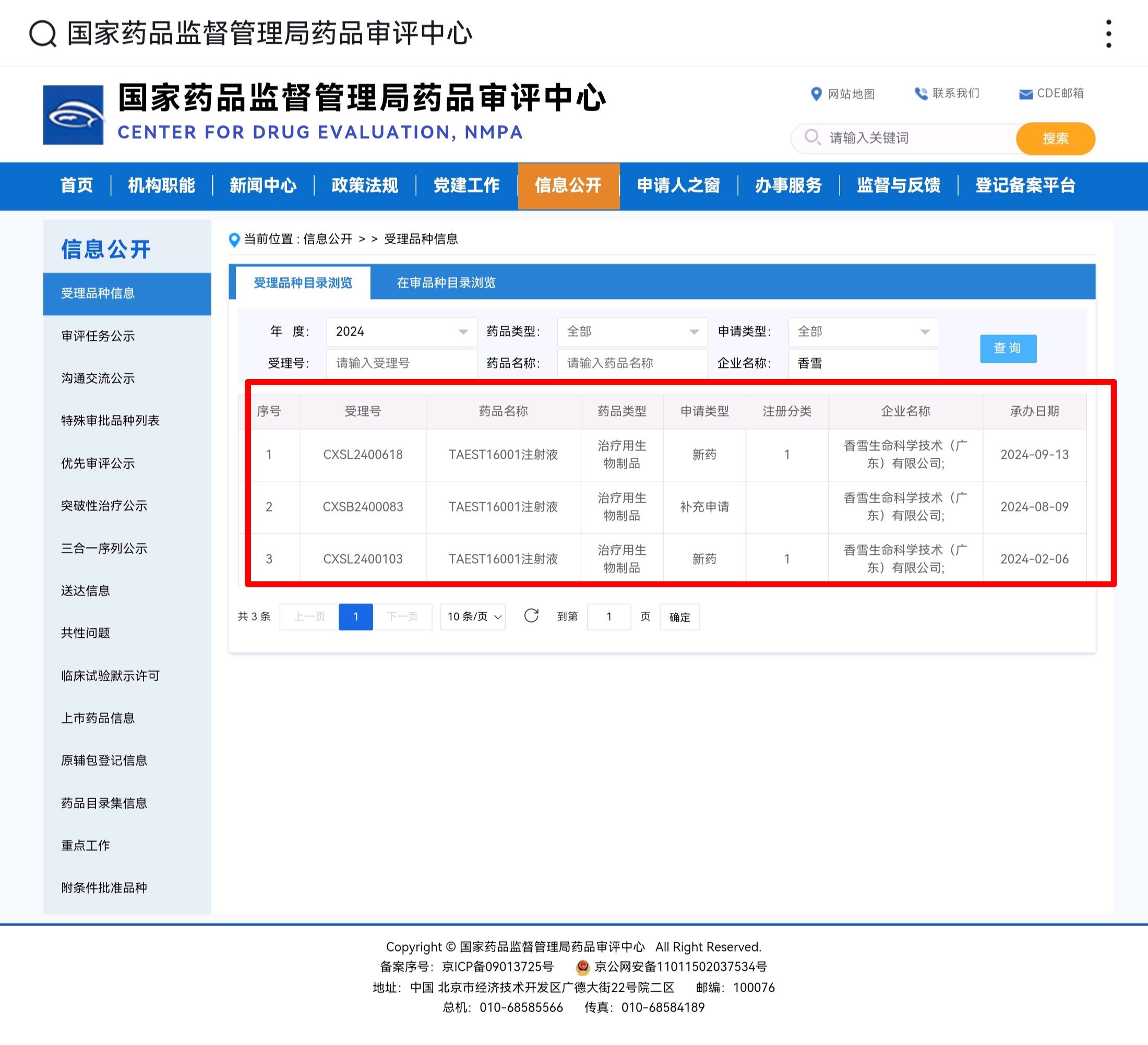
2024年7月30日,中国国家药品监督管理局(NMPA) 药品审评中心(CDE)官网最新公布显示,同意由广州市香雪制药股份有限公司子公司香雪生命科学(XLifeSC)申报的TAEST16001注射液纳入突破性治疗品种名单。这标志着TAEST16001注射液作为中国第一个IND获批开展临床试验的TCR-T细胞治疗新药取得重大突破,可加快关键性临床试验和附条件批准上市的进程,该药有望成为中国第一款上市的TCR-T细胞治疗药物,对中国免疫细胞治疗创新药的发展具有重要意义。
细胞免疫治疗是千亿级生物医药产业的重要分支。香雪生命科学搭建以企业为主体的创新平台,在TCR-T细胞免疫治疗关键技术和创新药开发上不断取得突破,助力大湾区生物医药产业高质量发展。在国内肿瘤细胞免疫治疗领域方面,广州本土药企正在积极参与全球竞争,持续造福患者和社会。
晚期实体瘤免疫治疗新突破,
TCR-T细胞治疗新药有望填补临床空白
CDE认定的“突破性疗法”是选择关注更优秀的临床数据、更差异化的临床靶点、更确定性的疗法,是探寻有价值新药项目的最高切入点。同时,CDE将纳入突破性治疗药物程序列为药品加快上市注册程序,这一工作程序受到了药品研发行业的普遍关注,突破性治疗药物的认定标准也成为业界和学术界关心的焦点之一。
软组织肉瘤是一组来源于间叶组织的实体恶性肿瘤,恶性程度高常规治疗效果差,存在较大的未被满足的临床需求。TAEST16001注射液是基于香雪生命科学TCR-T细胞产品技术开发平台和生产制备体系开发的第一个TCR-T细胞治疗产品,是中国首个获得IND批件和唯一进入II期临床试验的品,在针对NY-ESO-1阳性及HLA-A02:01阳性无治疗选择的晚期软组织肉瘤临床试验的数据显示了显著临床意义的治疗效果,是具有突破性和颠覆性的创新药品纳入CDE突破性治疗品种,临床试验数据显示,TAEST16001注射液在I期和II期临床试验中均表现出良好的安全性和耐受性,有望填补相关疾病治疗领域的临床空白,为晚期软组织肉瘤患者提供新的治疗选择,成为中国自主研发细胞治疗创新药研发的标杆。
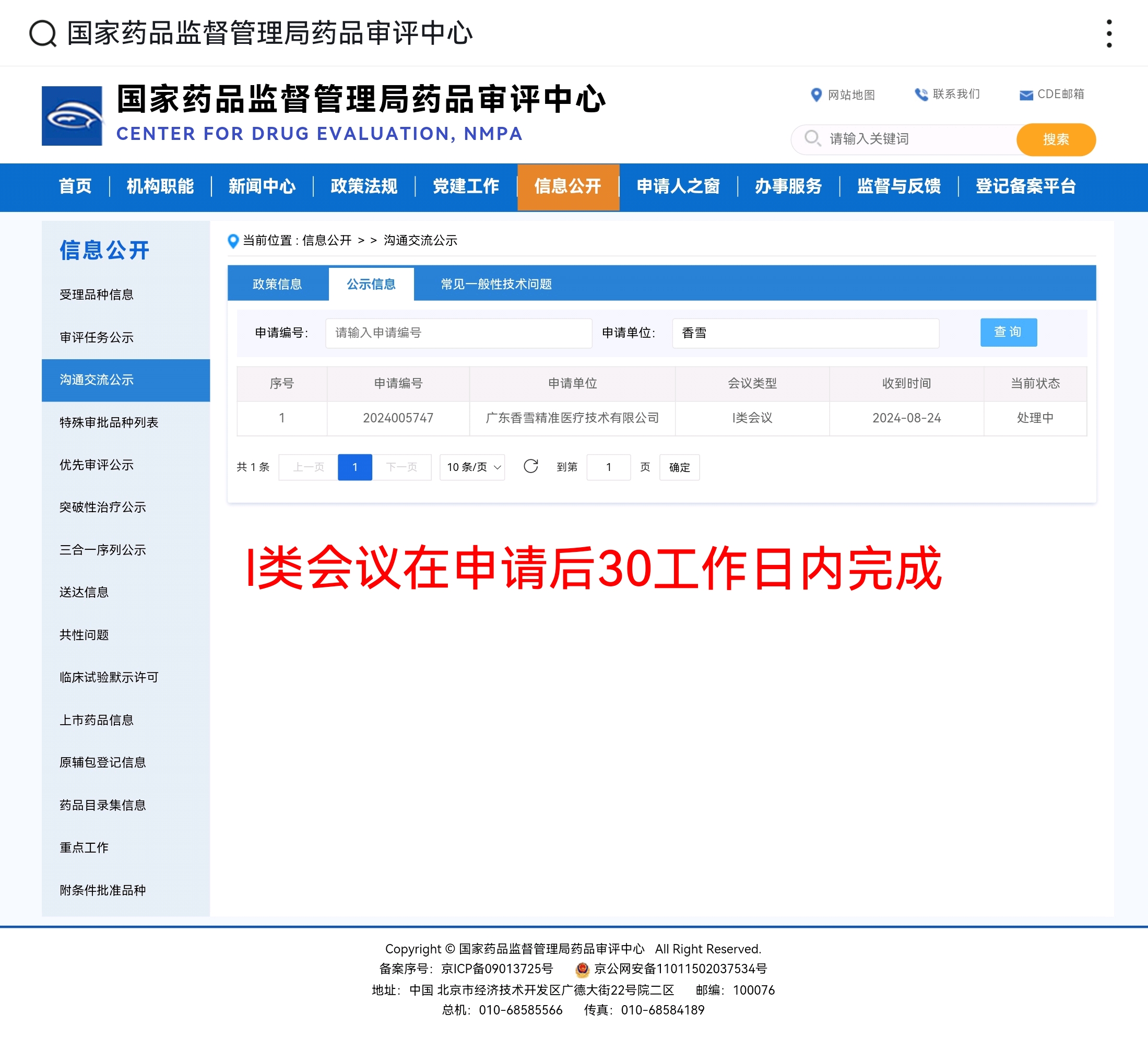
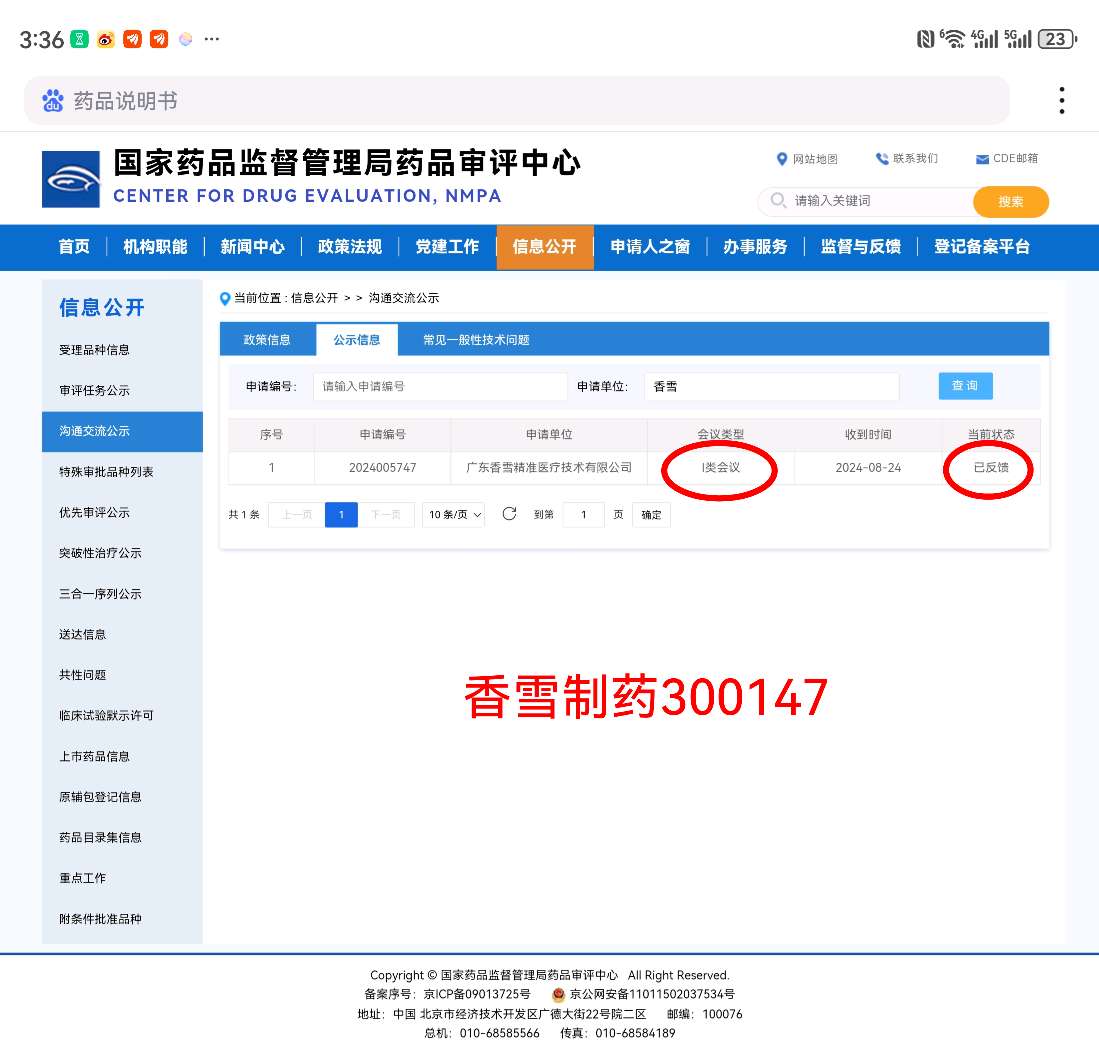
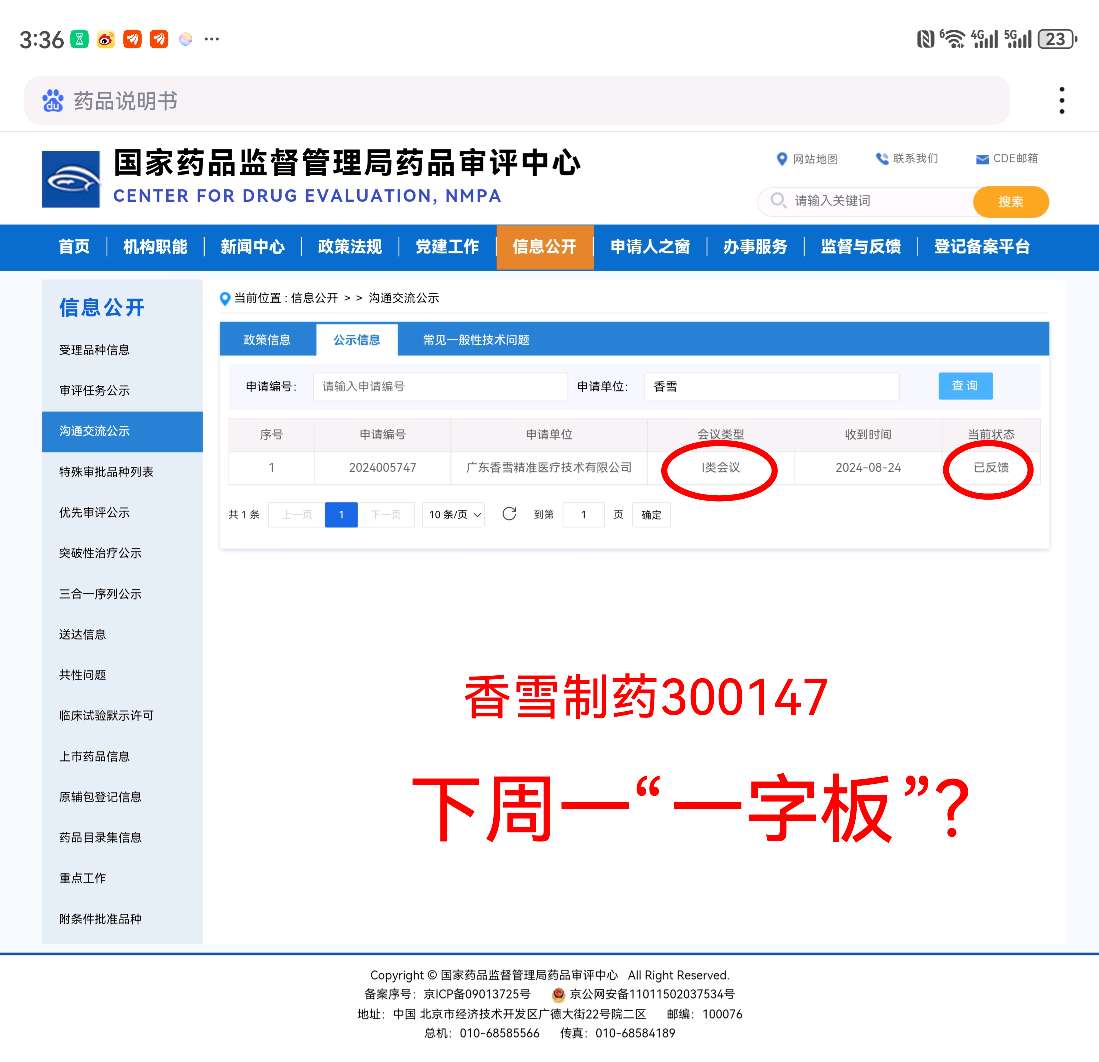
重磅!香雪制药TCR-T细胞治疗癌症创新药TAEST16001注射液列入突破性治疗品种后即将获批附条件上市,8月24日申请的I类CDE会议10月11日今天已获反馈。
下周一可能开盘即“一字板”,恭喜恭喜今天上车香雪的股友们!![看多 [看多]](http://gbfek.dfcfw.com/face/emot_default_28x28/emot74.png)
![看多 [看多]](http://gbfek.dfcfw.com/face/emot_default_28x28/emot74.png)
![看多 [看多]](http://gbfek.dfcfw.com/face/emot_default_28x28/emot74.png)
![福 [福]](http://gbfek.dfcfw.com/face/emot_default_28x28/emot50.png)
![福 [福]](http://gbfek.dfcfw.com/face/emot_default_28x28/emot50.png)
![福 [福]](http://gbfek.dfcfw.com/face/emot_default_28x28/emot50.png)
![献花 [献花]](http://gbfek.dfcfw.com/face/emot_default_28x28/emot49.png)
![献花 [献花]](http://gbfek.dfcfw.com/face/emot_default_28x28/emot49.png)
![献花 [献花]](http://gbfek.dfcfw.com/face/emot_default_28x28/emot49.png) $香雪制药(SZ300147)$
$香雪制药(SZ300147)$
香雪制药:目前立案调查事项未对公司生产经营产生重大影响,各项生产经营活动正常有序开展
每经AI快讯,有投资者在投资者互动平台提问:董秘您好:公司和董事长涉及的的信披违规,具体是哪项?
香雪制药(300147.SZ)10月11日在投资者互动平台表示,您好,感谢对公司的关注。公司收到立案告知书,目前在调查阶段,尚未有结论性意见或决定。公司将积极配合中国证监会的各项调查工作,并严格按照相关法律法规和监管要求及时履行信息披露义务。目前立案调查事项未对公司生产经营产生重大影响,各项生产经营活动正常有序开展。
文章来源:每日经济新闻
国家药品监督管理局药品审评中心的一类会议(Ⅰ类会议)是指为解决药物临床试验过程中遇到的重大安全性问题和突破性治疗药物研发过程中的重大技术问题而召开的会议。当这类会议已经反馈,通常意味着会议已经结束,并且药品审评中心已经就会议中讨论的问题提供了正式的反馈意见。
这些反馈意见可能包括对药物研发过程中的关键技术问题、安全性问题、临床试验设计、风险评估和控制等方面的意见或建议。这些反馈对于药品的研发和注册申请至关重要,因为它们可以帮助申请人(如药品研发企业)理解监管机构的审评标准和期望,从而指导他们调整研发策略,优化临床试验方案,控制药品研发过程中的风险,以及提高药品注册申请的成功率。
反馈的内容包括但不限于:
1.对现有研究数据的评估,是否支持拟开展的临床试验或上市申请。
2.对临床试验方案的评估,包括试验设计、受试者选择、给药剂量、疗效终点等。
3.对药品的安全性和风险管理计划的评估。
4.对药品的质量控制和药学研究的评估。
5.对于突破性治疗药物,可能还会讨论其潜在的临床优势和未满足的医疗需求。
这些反馈意见将帮助申请人在后续的研发和注册过程中做出相应的调整,以符合国家药品监督管理局的要求,从而推动药品的顺利上市。
本文作者可以追加内容哦 !

