IND正式获批

2024年10月25日,华道(上海)生物医药有限公司(以下简称“华道生物”)开发的首款针对CLDN18.2表达阳性的晚期实体瘤恶性腹腔积液治疗的细胞药物产品IND正式获国家药品监督管理局(NMPA)批准!
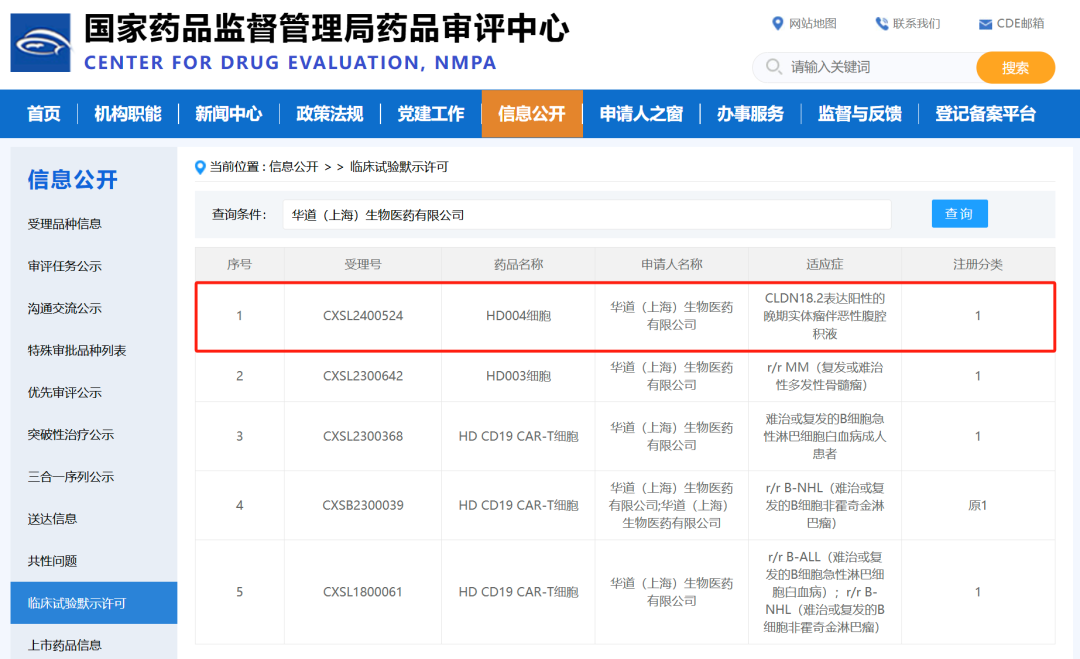

此前,2024年8月8日该款CAR-T药物(HD004细胞)获国家药品监督管理局药品审评中心(CDE)正式受理。截止目前为止,HD004细胞不仅是华道生物获得的第五个CAR-T细胞药物IND,也是华道生物采用自主产业技术(全封闭全自动细胞培养仪CCS)申请并获批的第四款CAR-T细胞药物1类新药IND,同时还是华道生物首款获批的针对实体肿瘤治疗的细胞药物,更是全球首个针对CLDN18.2表达阳性的晚期实体瘤恶性腹腔积液治疗的细胞药物产品。
CLDN18.2在胃癌、食管癌、巢癌、乳腺癌、肺癌等多种恶性肿瘤中呈高表达、与癌症发生、发展、转移和预后有关。
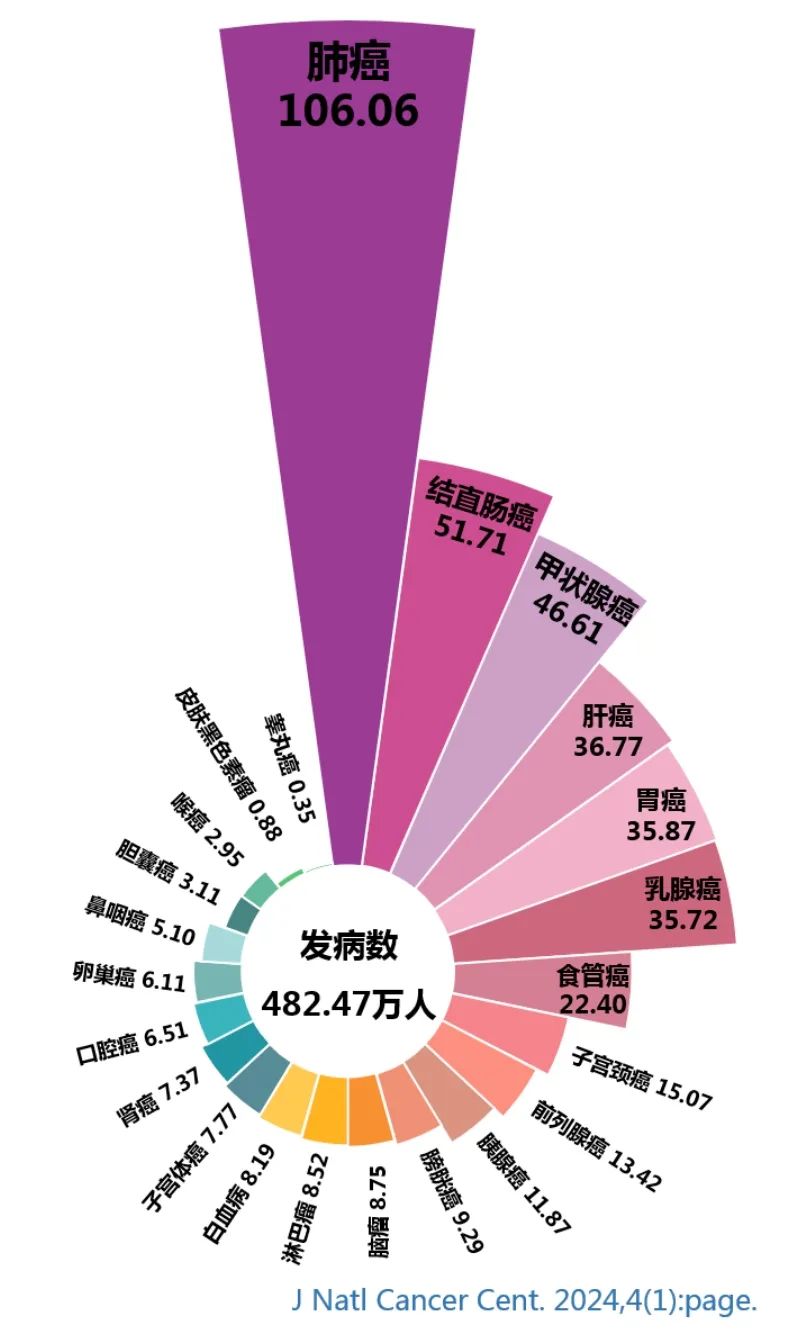
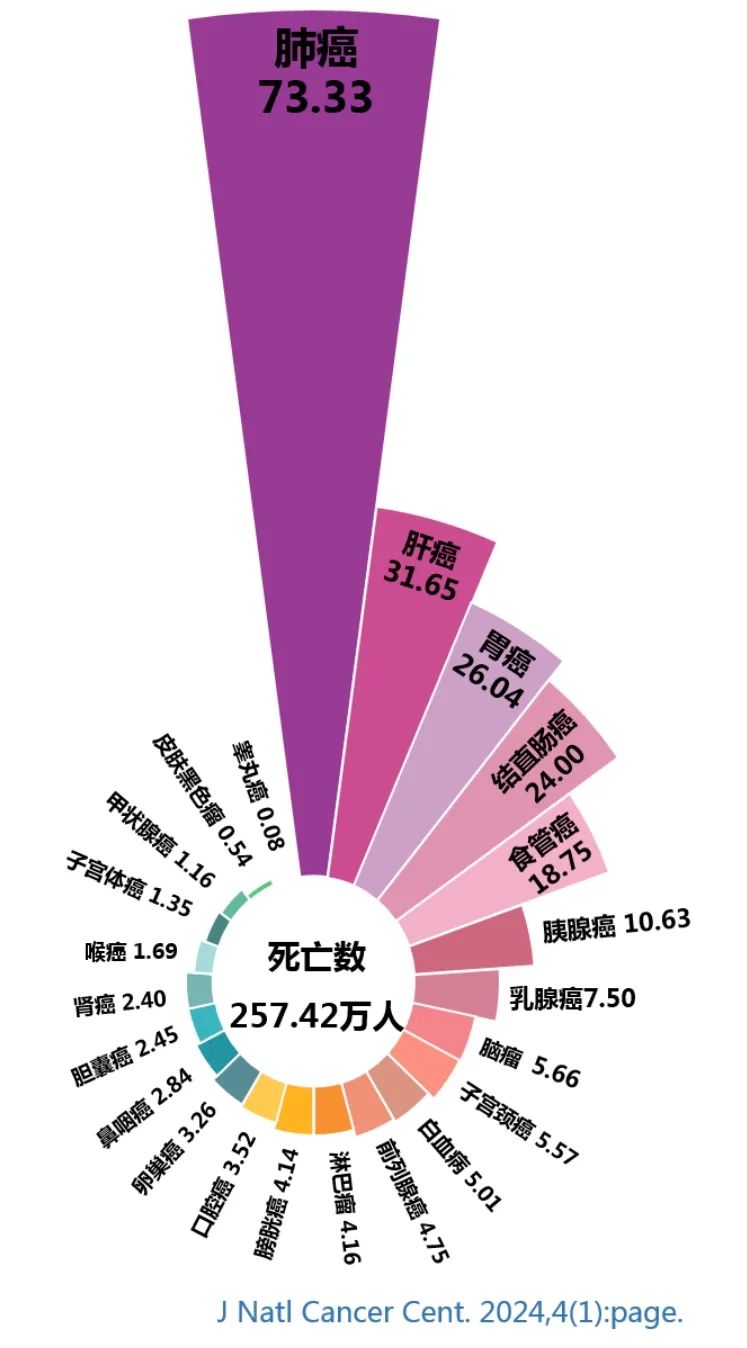
HD004细胞采用华道生物全产业链自主创新可及性细胞药物研发转化平台技术生产,具有价格亲民和未来医保可支付得起的特点,既满足晚期实体肿瘤伴恶性腹腔积液的患者的治疗需求,又符合国家药监局药物审评中心(CDE)发布的《以临床价值为导向的抗肿瘤药物临床研发指导原则》,将大幅延长该类肿瘤患者的生命周期和提高生存质量,更将对实体肿瘤患者术后防复发转移的综合治疗方案和肿瘤管理产生深远影响。
华道生物以“做中国老百姓用得起的细胞药物”为使命,坚持自主知识产权化的“细胞药物研发+产业化关键设备和技术攻关”的全产业链双创新道路,历经七年发展,攻克了细胞(CAR-T)制备关键生产设备、配套一次性耗材、智能化细胞(CAR-T)液氮冷链转运等细胞(CAR-T)产业化关键设备和卡脖子技术,成为了国内细胞免疫治疗领域拥有全产业链关键设备、试剂、耗材自主知识产权和掌握CAR-T细胞药物自主定价权的国家高新技术企业,致力于成为具有细胞药物自主创新研发和生产转化能力的平台型制药企业。

华道生物

华道(上海)生物医药有限公司(简称华道生物或公司)是一家专业从事细胞免疫治疗尤其专注细胞药物全产业链技术开发和创新的生物医药企业,2017年9月在上海张江成立,2020年搬迁落户上海松江,位于“松江创造”主阵地的国家级松江经济技术开发区内。

END

温
馨
提
示

1、“华道生物”公众号旨在分享华道文化、华道观点、华道动态等,且不限于分享行业法规、科普知识等进行学术交流,或传递行业前沿进展,不作为官方立场,不构成任何价值判断,不作为相关医疗指导或用药建议,无任何非法使用目的,仅供读者参考。
2、“华道生物”公众号原创文章可能包含需授权的文字、音频、图片、视频等,转载请谨慎。
3、“华道生物”公众号设计的图片、转载的图文、制作的视频等内容若涉及版权等问题,请联系我们及时处理删除。

