11月4日,港股科技创新型医药企业远大医药(00512)五官科板块眼科方向传来利好:公司用于眼科术后抗炎镇痛的全球创新激素纳米混悬滴眼液GPN00833完成了国内III期临床研究并成功达到了临床终点。
GPN00833临床优势显著,海外已获美国FDA批准上市
根据公司公告,GPN00833为一款抗炎镇痛类激素纳米混悬滴眼液,其主要活性成分丙酸氯倍他索是一种强效的糖皮质激素,具有高效的局部抗炎活性和较强的毛细血管收缩作用,同时,其独特的纳米制剂工艺有效解决了激素产品低水溶性导致的生物利用度低及安全性风险。
该产品于2023年4月在国内获批开展多中心、随机、双盲、安慰剂对照、平行分组III期临床研究,共入组了255例接受白内障手术的患者,以2:1的比例随机分配至研究药物组和安慰剂组,旨在评价GPN00833用于治疗中国人群白内障手术后炎症和疼痛的有效性和安全性。该研究的主要临床终点为评估白内障手术后至疗程结束的眼部炎症完全消失的受试者比例,次要临床终点为手术后至疗程结束的疼痛完全缓解的受试者比例。其中,消炎的指标为从术后第8天至第15天前房细胞计数为0;止痛的指标为从术后第4天至第15天疼痛评级为0。
研究结果显示,GPN00833可迅速且持久地清除眼部炎症和治愈眼部疼痛,效果在临床及统计学上均显著优于安慰剂。同时,该产品的安全性、耐受性良好,且药代动力学特征也符合预期。海外注册方面,该产品已于2023年3月获得美国FDA批准上市。
眼科市场规模持续增长,GPN00833或填补相应临床需求
近年来,随着大众生活方式及用眼场景、强度的改变,带来了更多眼科市场需求。Frost & Sullivan数据显示,2021年中国眼科市场规模已经达到2,100亿元人民币。根据灼识咨询数据,我国眼科药物市场规模预计将以22.9%的复合年均增长率增长至2030年的约202亿美元,超过同期全球眼科药物市场的增长。
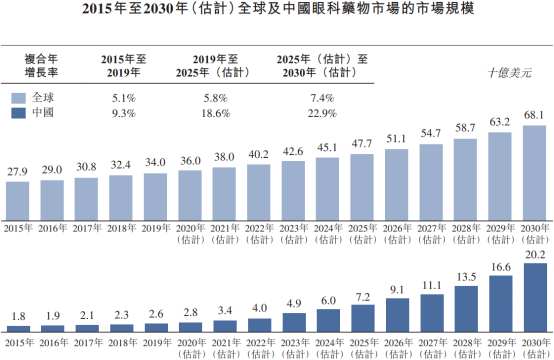
以白内障手术为例,根据Frost & Sullivan的数据,2022年中国每百万人中只有2,794例白内障手术,而美国同期每百万人中有8,580例白内障手术。国家卫健委印发的《“十四五”全国眼健康规划(2021-2025年)》提出,到2025年,要力争实现全国百万人口白内障手术率达到3,500以上。东吴证券研报预计,随着我国有效白内障手术覆盖率的不断提高,到2030年,我国白内障手术市场规模约为557亿元,2020年-2030年CAGR为10.38%。
据悉,GPN00833在内的激素眼用制剂是目前治疗眼部炎性反应最常用和最有效的药物之一,可以快速有效控制眼科术后的炎性反应和病情。但受限于眼用制剂技术能力,目前我国激素眼用制剂市场主要由进口产品主导,该细分市场近十年无新产品上市。从目前已上市的激素眼用制剂如地塞米松、泼尼松龙等来看,其成分多为传统糖皮质激素,此类药物长期应用不良反应较多,可能导致眼压升高,引发激素性青光眼、激素性白内障,从而诱发或加重感染。GPN00833基于其在临床试验中已被验证的安全性以及有效性优势,未来有望填补这一迫切的临床需求,产品市场潜力十分可观。
推进眼科创新产品研发,实现业务新突破
值得注意的是,远大医药作为我国主要的五官科药物研发、生产及销售综合企业之一,其在售产品管线数量位居行业前列。公司产品治疗领域覆盖眼科、耳鼻喉科、口腔科等多科室疾病,覆盖了化学制剂、中药制剂及健康产品,包含处方药、OTC、器械、消费品等几大类别,院内院外全渠道覆盖,并打造集“预防+治疗+保健”为一体的“大五官生态圈”。
在创新研发方面,远大医药储备了治疗“近视”、“干眼症”、“翼状胬肉”、“眼科术后抗炎镇痛”、“蠕形螨睑缘炎”和“蠕形螨导致的睑板腺功能障碍”的多款全球创新产品。
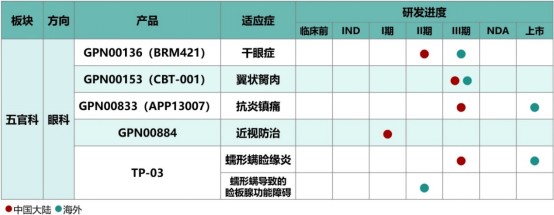
其中,用于治疗翼状胬肉的创新产品CBT-001于2023年3月获批在中国开展III期临床研究;用于治疗干眼症的小分子多肽药物GPN00136 (BRM421)于2023年4月获批在中国开展II期临床研究;用于延缓儿童近视进展的创新药物GPN00884于2024年6月完成中国I期临床首例患者入组给药;用于治疗蠕形螨睑缘炎及蠕形螨导致的睑板腺功能障碍的全球创新眼用制剂TP-03于2023年10月完成在中国开展的III期临床研究,海外注册方面,该产品已在2023年7月获得美国FDA批准上市,是目前FDA批准的首款也是唯一一款针对蠕形螨睑缘炎的药物。
远大医药表示,本次GPN00833国内III期临床顺利达到临床终点是公司五官科板块眼科方向的又一次重大里程碑进展。公司一直高度重视创新产品和先进技术的研发,坚持以科技创新为驱动,针对尚未满足的临床需求,加大对全球创新产品和先进技术的投入。未来,公司该板块将秉持中西联合和药械同治的发展战略,不断强化行业影响力,实现业务领域新突破。
本文作者可以追加内容哦 !

