今日(11月22日),中国国家药监局药品审评中心(CDE)官网公示,阿斯利康(AstraZeneca )和安进(Amgen)共同申报的特泽利尤单抗注射液上市申请已获得受理。公开资料显示,这是靶向抗胸腺基质淋巴细胞生成素(TSLP)的单克隆抗体tezepelumab(Tezspire)。该疗法在2021年12月获美国FDA批准用以作为附加维持疗法,治疗12岁以上儿童和成人严重哮喘患者。业内知名机构Clarivate曾指出,这款疗法有望在2026年成为“重磅”新药。
根据申请的注册分类,推测本次该产品在中国申报上市的适应症为可能为治疗12岁以上儿童和成人严重哮喘患者。同时阿斯利康官网管线信息也指出,拟在中国市场申报该药的首个适应症为治疗严重哮喘。
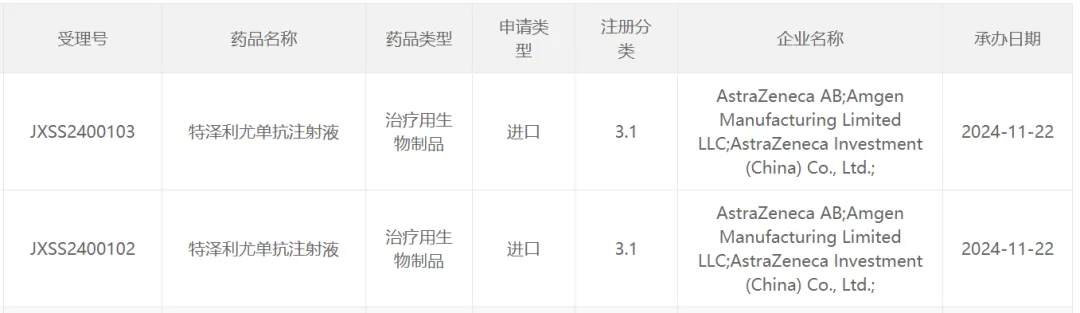
截图来源:CDE官网
TSLP是位于许多炎症级联反应顶端的上皮细胞因子,能引发对过敏性、嗜酸性和其他类型气道炎症的过度免疫反应。
Tezepelumab在2021年12月获美国FDA批准作为附加维持疗法,治疗12岁以上儿童和成人严重哮喘患者。FDA于2018年9月授予tezepelumab突破性疗法认定,用于治疗无嗜酸性粒细胞表型的重度哮喘患者。它的生物制品上市申请也获得FDA的优先审评资格。在临床应用中,该产品只需每4周一次皮下注射给药。

FDA这一批准是基于名为PATHFINDER的临床开发项目,包括关键性3期临床试验NAVIGATOR的结果。NAVIGATOR试验结果于2021年5月发表在《新英格兰医学杂志》上。试验结果显示,在治疗症状未受控制的重度哮喘患者时,tezepelumab达到试验所有主要终点和关键性次要终点。与安慰剂相比,将每年哮喘急性加重率(AAER)降低56%。
除了重度哮喘,tezepelumab还正被开发用以治疗其他潜在适应症,包括慢性阻塞性肺病、伴有鼻息肉的慢性鼻窦炎、慢性自发性荨麻疹和嗜酸性食管炎。该产品今年8月还获得FDA授予的突破性疗法认定,作为附加维持疗法,治疗中度至极重度慢性阻塞性肺病(COPD)患者。
根据中国药物临床试验登记与信息公示平台信息,目前tezepelumab针对成人重度哮喘的3期临床研究已经完成,治疗5岁以上、12岁以下未受控制的重度哮喘儿童患者的研究正在招募中。
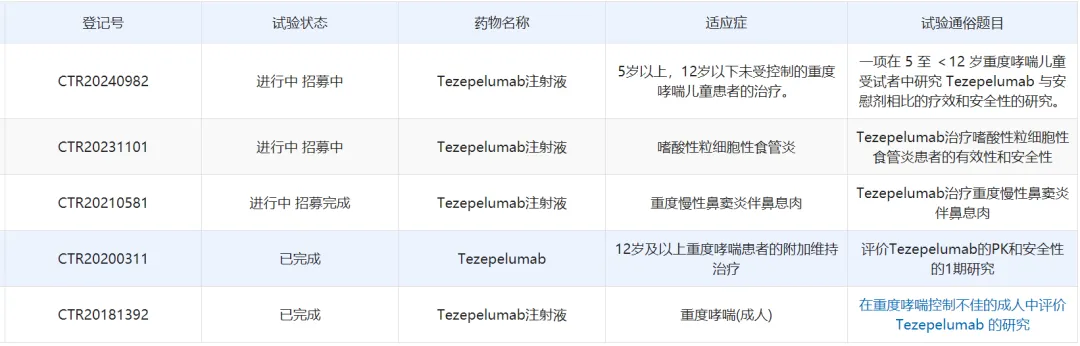
图片来源:中国药物临床试验登记与信息公示平台截图
$阿斯利康(US ADR)(NASDAQ|AZN)$$来凯医药-B(HK|02105)$$美中嘉和(HK|02453)$#工信部:加快大模型技术迭代和产品升级#
来源:医药观澜
免责声明:转载内容仅供读者参考,版权归原作者所有,内容为作者个人观点,不代表其任职机构立场及任何产品的投资策略。本文只提供参考并不构成任何投资及应用建议。如您认为本文对您的知识产权造成了侵害,请立即告知,我们将在第一时间处理。
本文作者可以追加内容哦 !

