GLORY-1研究即将亮相ADA2024且被评重大突破,听药学专家说说“减重新星”玛仕度肽的分子故事
引言
备受瞩目的第84届美国糖尿病协会科学年会(ADA2024)即将于本周在美国奥兰多召开,纪立农教授将在会上公布重磅研究GLORY-1的详细数据,这是全球推进最快的GLP-1/GCG双受体激动剂玛仕度肽的3期研究,被ADA大会评为本年度“重大突破”。这款来自创新药企信达生物的产品,得到了全球学者的诸多关注。
今天,就让我们跟随药学专家吕晓希教授一起,聊一聊这款“基于人体天然激素OXM开发,既能科学减重,又可燃脂护肝,实现全面代谢获益”的减重新星——玛氏度肽的分子故事。
GLORY-1:减重同时全面改善代谢指标,一站式解决中国超重/肥胖患者的难题

图1. ADA官方期刊Diabetes网站公布的GLORY-1研究摘要
ADA网站本周公布的摘要显示了GLORY-1的结果(图1)。这是一项专门针对中国人群的研究,其主要终点为治疗32周减重百分比,玛仕度肽4 mg、6 mg治疗组受试者体重较基线平均减少10.97%、13.38%,安慰剂组减少0.24%。关键次要终点为治疗48周减重百分比, 玛仕度肽4 mg、6 mg治疗组受试者体重较基线平均减少12.05%、14.84%,安慰剂组减少0.47%。
值得一提的是,玛仕度肽治疗组患者不仅体重明显下降,而且代谢指标都得到明显改善,血压、甘油三酯、总胆固醇、低密度脂蛋白胆固醇(LDL-C)、谷丙转氨酶(ALT)均明显降低。此外,研究还观察到血尿酸水平显著下降(相比安慰剂组,玛仕度肽组血尿酸下降50.75 μmol/L),这在其他胰高血糖素样肽-1受体激动剂(GLP-1RA)产品相关研究中并未观察到。
此外,GLORY-1研究的目标患者不仅有体重指数(BMI)≥28 kg/m2的肥胖患者,还有BMI 24~28 kg/m2同时伴有≥1个代谢合并症的超重人群,包括糖尿病前期、高血压、血脂异常、脂肪肝、高尿酸血症、负重关节疼痛、阻塞性睡眠呼吸暂停综合征等,非常贴近中国临床现状。
GLP-1RA家族:从单靶升级到多靶,背后是尚未被满足的临床需求
01
单靶激动剂未能完全满足减重和代谢获益的需求
肥胖带来的健康和社会经济负担愈发沉重,患者对减重药物的需求也日益增加。GLP-1RA通过促进胰岛素释放、抑制食欲,在临床上用于糖尿病治疗,并在国外获批用于肥胖症治疗,为代谢异常患者带来了一定程度的帮助。
然而,即便高剂量的GLP-1RA,减重幅度也仅约8%~10%,且大剂量的药物背后是严重的恶心和胃肠道不适等不良反应。此外,超重和肥胖患者常合并高血压、脂肪肝、高尿酸血症、高脂血症等诸多问题,并未得到有效解决。
02
多靶点激动剂成研发热点,GLP-1/GCG双靶既减重又燃烧肝脏脂肪,潜力巨大
应对上述临床诉求,研究人员采取了“联合激动剂”策略,将GLP-1与胰高血糖素原家族的相关激素和相关肽相结合。其中,胰高血糖素(GCG)的激活已被证明对脂质代谢、食物摄入和能量消耗产生有益影响。
同时激动GLP-1受体和GCG受体可发挥调控食欲、增加能量消耗、促进胰岛素释放及细胞保护等作用,不仅表现出良好的减重和改善血糖的效果,还能燃烧肝脏脂肪,全面改善代谢指标[1]。在肥胖动物模型中,与单独使用GLP-1RA相比,同时激动GLP-1受体和GCG受体可带来更佳的减重效果、更低的血糖水平和更少的食物摄入量,是非常有治疗潜力的减重策略,因而得到药物研发人员的重点关注。
理想与现实碰撞:GLP-1/GCG双受体激动剂研发之路困难重重
困难1:半衰期极短,是开发路上的重要难题
GCG和GLP-1均是由胰高血糖素原剪辑加工形成的多肽,两者都含有二肽基肽酶-4(DPP-4)的识别位点,易被DPP-4切割而迅速失效[2]。因此,天然GCG的半衰期约为10分钟,天然GLP-1的半衰期仅2~3分钟。如何有效延长二者的半衰期,是GLP-1和GCG相关药物研发中需要克服的重要难题。
困难2:如何平衡好GLP-1受体和GCG受体的激动比例,以实现最佳获益
GCG受体的激活,一方面会提高基础代谢率,促进脂肪分解;另一方面也会促使肝脏糖原分解而产生葡萄糖,导致机体血糖升高。联合GLP-1受体的共同激动,可以最大化GCG受体的体重获益,同时实现降糖获益[3]。所以,需充分考虑药物对各个靶点的亲和力及激动效率,完美均衡GLP-1受体和GCG受体的激动比例。
玛仕度肽突破研发壁垒:成为全球推进最快的GLP-1/GCG双受体激动剂
01
返璞归真——从人体天然OXM激素出发,最小幅度改动
内源性肽类分子是宝贵的药物研发资源,基于内源肽类氨基酸序列开发的多肽类似物通常具有更好的理化性质和更低的免疫原性[4]。
胃泌酸调节素(OXM)是人体分泌的天然肽类激素,作为GCG的内源性前体,它含有完整的GCG序列,且与GLP-1及Exendin-4具有“高度同源性”,可同时激动GLP-1受体和GCG受体[5]。
玛仕度肽的研发者们基于这种“高度同源性”,对天然OXM进行了结构优化,不仅有效避免了DPP-4的切割,而且提升了多肽对GLP-1受体的激动活性,有效平衡了GLP-1受体/GCG受体的双重激动作用,奠定了良好的临床应用基础(图2)。
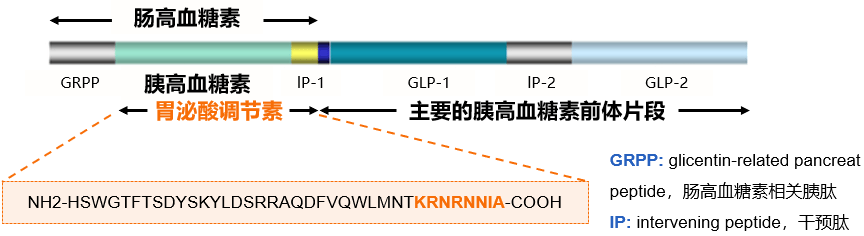
图2. OXM及GLP-1的多肽片段
关于OXM的更多知识,详阅下文:
新一代减重药!基于OXM的GLP-1R/GCGR双重激动剂即将上市,捋一捋OXM的前世今生
02
替换关键氨基酸阻止被DPP-4降解,增加药物稳定性
玛仕度肽的研发者们将OXM的N端2位处替换为Aib(图3)以阻止DPP-4介导的降解,从而增强其对DPP-4的抵抗,以增加药物在体内的代谢稳定性,延长药物的作用时间。使用Aib进行取代还能够保留OXM本身的生物活性及受体结合亲和力。此外,玛仕度肽C端的酰胺及螺旋结构也增强了其稳定性。
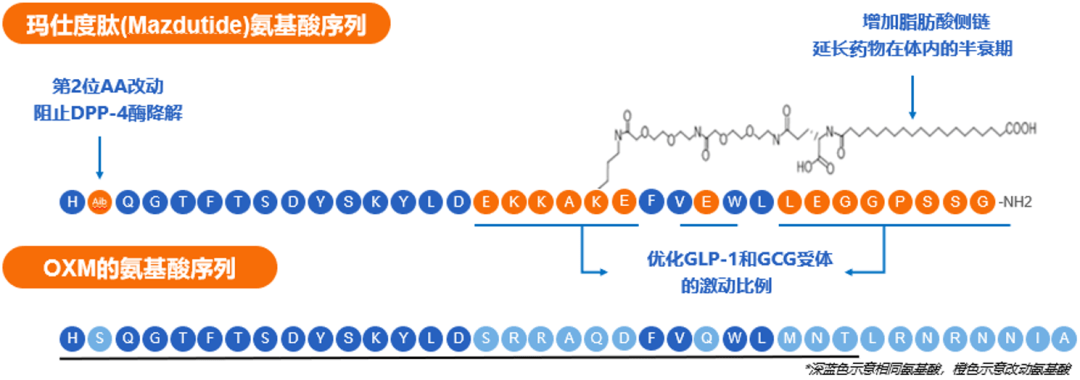
图3. 玛仕度肽的氨基酸序列及基于OXM的修饰
03
增加脂肪酸侧链,延长药物半衰期
玛仕度肽的研发者们在OXM中部的赖氨酸(图3)上连接了脂肪酸侧链,促进药物与血清白蛋白的结合,从而减少肾清除,以延长药物在体内的半衰期。
04
调整氨基酸序列,优化激动比例,实现最大获益
玛仕度肽的研发者们将Exendin-4的C端区域引入到OXM中,又修改了OXM的中间区域(为EKKAKE),有效提升了GLP-1受体的激活效力(图3),由此达到GLP-1受体/GCG受体的最佳激动比例,使得玛仕度肽表现出良好的综合效益,并在临床试验中得到了验证。
玛仕度肽首个上市申请已在2024年2月获国家药品监督管理局(NMPA)受理,用于成人肥胖或超重患者的长期体重控制,并预计于2025年在中国上市。
本文作者可以追加内容哦 !

