近期,Natera公司收到美国医疗保险和公共医疗补助服务中心关于Signatera分子残留病灶 (MRD) 检测满足肌肉浸润性膀胱癌 (MIBC) 患者覆盖要求的书面确认,至此,Signatera已有3个应用方向获得美国医保覆盖,分别是II、III期肠癌全程监测、泛癌免疫治疗疗效监测和肌肉浸润性膀胱癌监测。

约50%肌层浸润性膀胱癌患者在接受根治性治疗后仍会出现远处转移[4],且前三年的复发转移率高达90%[5-6],这为临床带来了极大的挑战。近期美国医保的这一决议让Signatera MRD评估纳入膀胱癌的标准护理中,可帮助临床医生更精准地了解患者病情,为后续治疗管理提供有意义的信息,让膀胱癌患者得到更多获益。
本次医保扩项基于Signatera技术在膀胱癌监测研究中的优异表现,其研究成果分别于2019年和2021年发表在JCO和Nature上 。小编在此将回顾这两个研究的主要结论:
【Nature 2021】IMvigor010全球大型III期随机临床试验的反转性成果:Signatera-ctDNA检测可指导膀胱癌术后辅助免疫治疗[2]
研究者对根治性膀胱切除术后的患者采血进行Signatera检测,发现MRD术后阳性患者通过阿替利珠单抗 (Atezolizumab) 进行辅助免疫治疗,总生存期可延长10个月 (图1),进而表明MRD状态可以作为膀胱癌阿替利珠单抗辅助治疗的患者分层标志物,术后阳性患者接受治疗将获益。
此外,Signatera在患者接受免疫治疗的早期阶段起到疗效评估和预后预测的作用。在治疗的前2个周期,Signatera-ctDNA清零 (即:阳转阴) 的患者比未清零患者具有更长的生存期 (图2)。(查看:“反转&突破|快速判断免疫治疗疗效--Signatera MRD检测再登《Nature》”)
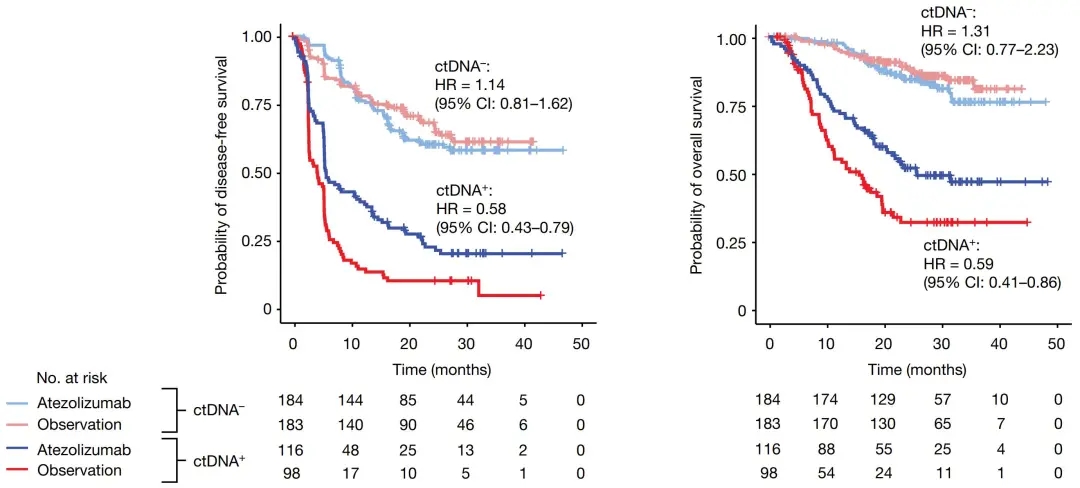
图1. 术后ctDNA (MRD) 阳性与阴性患者的DFS与OS对比
术后辅助治疗前ctDNA阳性 (即MRD阳性) 患者占37% (深蓝色线),这类患者能从阿替利珠单抗辅助治疗中获益,中位总生存期延长10个月 (OS 25.8vs.15.8个月),HR=0.59, 即死亡风险降低41%;中位无疾病生存期延长1.5个月 (DFS 5.9vs.4.4个月);而ctDNA术后阴性 (即MRD阴性) 患者无论是否治疗,生存无明显差异。
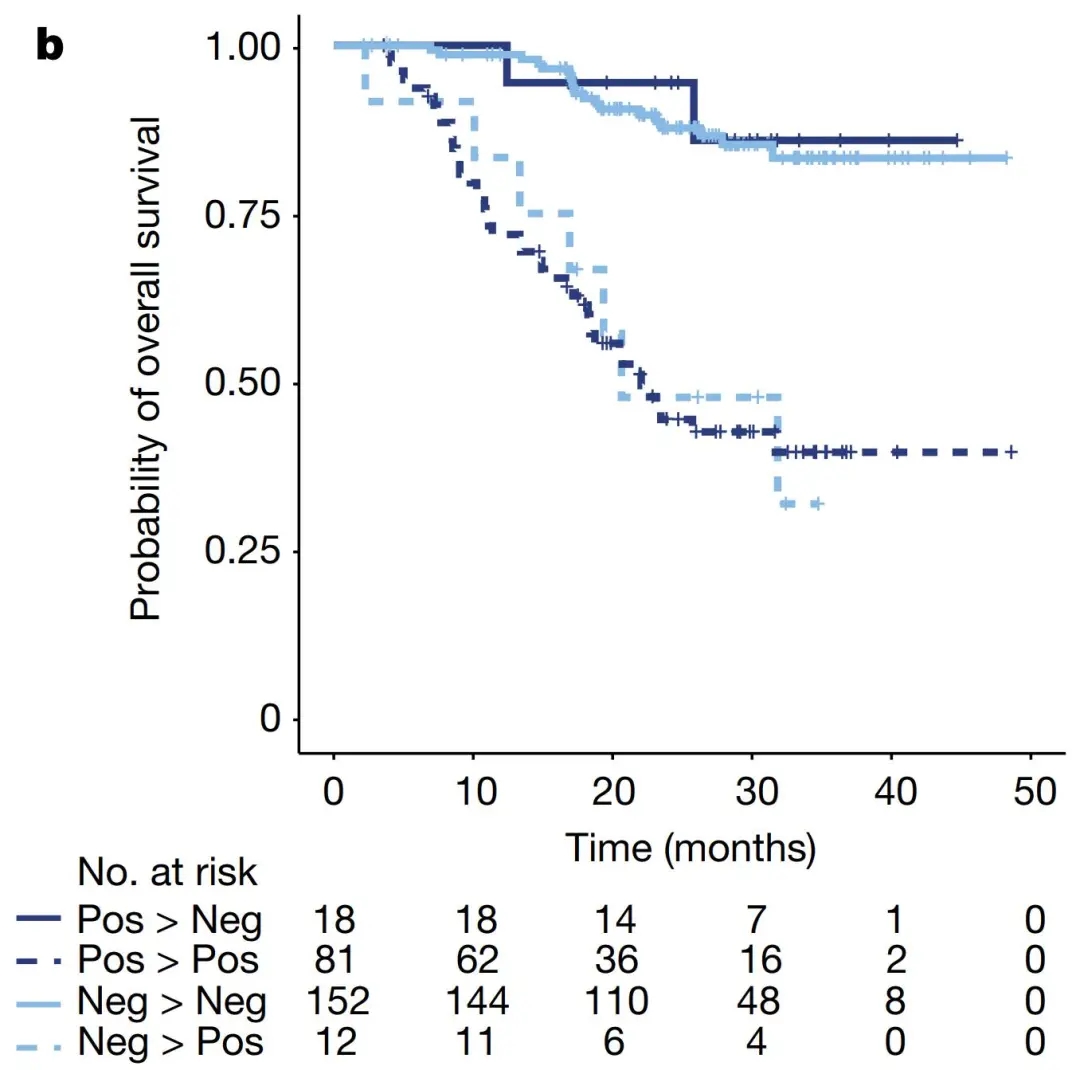
图2. 治疗2周期 (6周后) ctDNA的清除情况与患者总生存率。如深蓝色实线所示,能在治疗初期快速清零 (阳转阴) 的患者的总生存期和术后一直保持阴性的患者相仿 (浅蓝色实线),显著优于未清零的患者 (深蓝色虚线) 或治疗期间复阳的患者 (浅蓝色虚线)。
【J Clin Oncol 2019】Signatera-ctDNA检测在膀胱癌患者术后的复发转移监测和疗效评估研究[3]
采用Signatera-MRD检测对68名晚期肌肉浸润性膀胱癌 (MIBC) 患者进行复发监测,术后Signatera的监测复发转移的敏感性达100%,特异性达98%,比影像学中位提前96天发现复发。
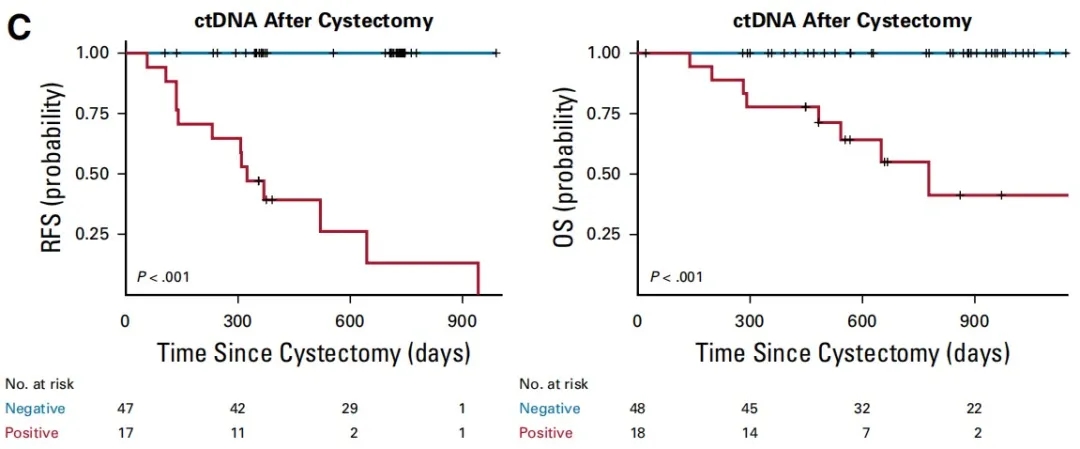
图3. Signatera-ctDNA术后阳性患者与阴性患者的无复发生存期 (RFS) 和 总生存期 (OS) 对比。术后阴性的患者 (蓝线) 的生存期显著高于术后阳性的患者(红线)
Signatera MRD检测为何能做到如此精准?请查阅相关报道。(点击查看)
结 语
Signatera MRD目前已积累了多个癌种的数千例临床验证数据,获得国外临床专家和监管部门认可 (NCCN结直肠癌指南引用,FDA突破性医疗器械认定、CE认定、美国Medicare政府医保覆盖)。2019年,华大基因与美国著名的液体活检公司-Natera公司签订了独家技术引进协议,成为中国唯一提供Signatera MRD检测的机构 (中文名:华见微肿瘤MRD定制化检测)。
借助华大基因的国产自主测序平台,华见微可以惠及更多中国患者,帮助患者实现更长、更好的生存,助力高效新药临床试验设计。
本文作者可以追加内容哦 !
![怒 [怒]](http://gbfek.dfcfw.com/face/emot_default_28x28/emot6.png)


