临床试验失败、裁员、退市、解散,这家明星Biotech已走完它的一生
12月19日,Otonomy宣布公司董事会在进行战略选择评估后已批准并通过了一项清算和解散计划,其中包括出售管线和有序结束公司运营后向股东分配剩余现金。该公司自创立至今已有14年之久,回顾其发展历程,也许可以算得上是一部Biotech凋亡史。

Otonomy是一家致力于开发针对听力损失和耳鸣的新疗法的公司,其成立原因非常简单——创始人Jay Lichter博士确诊梅尼埃病(Mnire's disease)。梅尼埃病是一种定义为原发性内淋巴水肿综合征的临床疾病,是眩晕的常见原因之一。其典型临床症状为前庭和耳蜗症状突然发作,可伴耳鸣。梅尼埃病患者的反复眩晕发作可达96.2%,耳鸣达91.1%,同侧听力下降87.7%。当时Jay Lichter博士得知这种疾病在全球范围内皆无药可治,于是他决定创立一家公司,便和加州大学圣地亚哥分校耳鼻喉科/头颈外科主任Jeffrey Harris博士以及其他几位神经学专家一起成立了Otonomy。 在公司刚创立的前几年,Otonomy发展得并不顺利,直到2013年才完成了第三轮融资,也就是这一年投资人开始真正看好Otonomy的前景。2014年8月,Otonomy在纳斯达克上市,股票发行价为16美元/股。当时Otonomy手里有一款改良型新药OTO-201(6%环丙沙星耳用混悬液),拟开发的适应症为单次剂量治疗接受鼓膜置管术(TTP)后的儿科患者(6个月及以上)的双侧中耳炎伴积液症状。这种疾病当时还没有针对性疗法,临床上的常规治疗方案为长时间、多剂量滴定抗生素。 顺利融资之后,Otonomy全力推进OTO-201的开发。2014年7月,Otonomy宣布OTO-201的两项III期临床试验达到主要终点,可显著降低治疗失败的发生率。一年之后,OTO-201在美国获批上市,商品名为AuriPro(后更名为Otiprio),成为第一款用于治疗TTP期间的中耳积液的药物。后来这款产品于2018年将适应症扩展至在6个月及以上年龄的儿科患者中治疗铜绿假单胞菌和金黄色葡萄球菌引起的急性外耳炎。

当时,Otonomy管线中还有两款在研药物:OTO-104(Otividex)和OTO-311(后更名为OTO-313)。OTO-104是一款地塞米松长效缓释注射液,拟开发用于治疗梅尼埃病;OTO-311的活性成分为加环利定,后者是益普生开发的一种NMDA受体拮抗剂,拟开发用于治疗耳鸣。 就在OTO-201获批的那一年(2015年),Otonomy启动了OTO-104治疗梅尼埃病的第一项III期研究(AVERTS-1),紧接着又在2016年启动了三项III期研究,颇有冲锋意味。2017年8月,Otonomy宣布AVERTS-1研究未达到主要终点并决定暂停该产品的所有开发项目。此后半个月,该公司股价一路走低,从20.80美元/股跌至3.50美元/股,Otonomy只好裁员三分之一以节省开支。 但随后Otonomy又在公布2017年第三季度财报时宣布,OTO-104的另一项III期AVERTS-2研究成功,可显著改善梅尼埃病患者的眩晕症状。第二年Otonomy启动了OTO-104的第五项III期研究,当时Otonomy的打算是如果这项研究也成功就递交该产品的上市申请。然而天不遂人愿,研究失败了,Otonomy无奈终止开发OTO-104。此时该公司股价已跌至2.88美元/股。 截至2021年5月,Otonomy管线中共6款在研产品。其中,OTO-313和OTO-413是仅剩的两款临床阶段产品。

Otonomy公司2021年第一季度财报(来源:Otonomy官网)
在OTO-104开发失利后,Otonomy将精力放在了OTO-313上。刚开始OTO-313的开发还算顺利。2019年4月,Otonomy启动了该产品的I/II期临床试验。一年之后,该研究顺利达到主要终点,OTO-313可显著改善中度以上持续性耳鸣患者的耳鸣症状。2021年3月,OTO-313推进至II期临床。然而,今年8月,Otonomy遗憾宣布OTO-313的II期研究未达到显著改善患者耳鸣症状的主要终点,并将终止开发该产品,公司股价因此大跌近80%,从1.43美元/股跌至0.25美元/股。
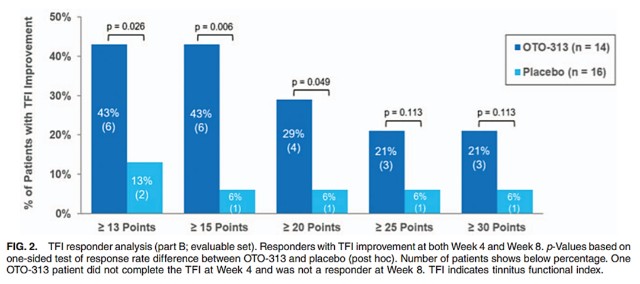
OTO-313的I/II期研究结果(来源:Otology & Neurotology)
两款核心产品相继失利后,OTO-413成为了Otonomy的最后一根救命稻草。OTO-413的活性成分为脑源性神经营养因子(BDNF),后者是一种参与神经元生长和修复的天然蛋白质。非临床研究表明,局部施用BDNF可修复因噪音创伤或接触耳毒性化学物质而受损的耳蜗内毛细胞和听觉神经纤维之间的连接。今年4月,Otonomy宣布OTO-413治疗噪声性听力损失的IIa期研究成功。结果显示,在接受OTO-413(0.3mg)治疗后的第57天和第85天,40%患者在三项噪音中语句(SIN)测试中至少有一项获得临床意义上的改善(安慰剂组为20%),15%患者在SIN测试中改善两项及以上(安慰剂组为0%)。此外,50%患者的患者整体印象变化量表(PGIC)评分相较于基线有临床意义上的改善(安慰剂组为10%)。基于此结果,Otonomy计划于2022年底启动全剂量范围的II期临床试验。
但是,命运再一次戏弄了Otonomy。今年10月,OTO-413的高剂量队列研究结果出炉。结果显示,接受0.75mg剂量和1.50mg剂量OTO-413的患者的SIN测试结果无临床意义改善。对此,Otonomy表示可能是BDNF复杂的剂量-效应关系所致。基于此结果,该公司宣布启动战略选择评估并暂停手头所有研究。消息一出,Otonomy股价又跌去53%,从0.26美元/股跌至0.121美元/股。
11月14日,纳斯达克向Otonomy发出退市警告,因其股票在连续10个交易日内收盘价低于0.10美元/股。12月19日,Otonomy宣布解雇所有员工并计划解散公司。解散计划目前已获公司董事会批准,Otonomy预计在2023年第一季度召开股东特别会议以寻求批准解散计划。如果解散计划获得批准,Otonomy 打算提交解散证书,将其普通股股份退市。
Otonomy的故事令人唏嘘。新药研发的道路总是充满了未知数,幸运者一路起朱楼“药财双收”,不幸者常常半路“塌房”进退两难。尤其是“寒气”逼人的今年,停管线、裁员、卖资产已是司空见惯。但即使如此,还是有很多企业顶着冽冽寒风坚定地向前走。
推荐阅读
Copyright 2022 PHARMCUBE. All Rights Reserved.
欢迎转发分享及合理引用,引用时请在显要位置标明文章来源;如需转载,请给微信公众号后台留言或发送消息,并注明公众号名称及ID。
免责申明:本微信文章中的信息仅供一般参考之用,不可直接作为决策内容,医药魔方不对任何主体因使用本文内容而导致的任何损失承担责任。
郑重声明:用户在社区发表的所有信息将由本网站记录保存,仅代表作者个人观点,与本网站立场无关,不对您构成任何投资建议,据此操作风险自担。请勿相信代客理财、免费荐股和炒股培训等宣传内容,远离非法证券活动。请勿添加发言用户的手机号码、公众号、微博、微信及QQ等信息,谨防上当受骗!

郑重声明:东方财富网发布此信息的目的在于传播更多信息,与本站立场无关。东方财富网不保证该信息(包括但不限于文字、视频、音频、数据及图表)全部或者部分内容的准确性、真实性、完整性、有效性、及时性、原创性等。相关信息并未经过本网站证实,不对您构成任何投资建议,据此操作,风险自担。

