4月19日,Ardelyx宣布已重新向FDA提交磷酸盐抑制剂tenapanor(Xphozah)的新药上市申请(NDA),用于治疗接受透析的对磷酸盐结合剂治疗反应不足或不耐受的成年慢性肾病(CKD)患者的高磷血症。Ardelyx预计FDA将在5月中旬作出NDA受理决定,并预计Xphozah将在今年下半年获批上市。  Xphozah的上市之路相当不顺,Ardelyx为此付出了大量心血。故事可以追溯到三年前。2020年6月,基于3项III期临床试验(PHREEDOM、AMPLIFY和BLOCK)的结果,Ardelyx向FDA提交Xphozah用于治疗透析CKD成人患者的高磷血症的上市申请。 这3项研究共纳入1019例患者,均达到了主要终点和关键的次要终点。在PHREEDOM研究中,Xphozah(30mg)组患者的血清磷水平相比安慰剂组平均降低1.37mg/dL;在AMPLIFY研究中,Xphozah(30mg)组患者的血清磷水平平均降低0.84mg/dL,安慰剂组则降低0.19mg/dL。
Xphozah的上市之路相当不顺,Ardelyx为此付出了大量心血。故事可以追溯到三年前。2020年6月,基于3项III期临床试验(PHREEDOM、AMPLIFY和BLOCK)的结果,Ardelyx向FDA提交Xphozah用于治疗透析CKD成人患者的高磷血症的上市申请。 这3项研究共纳入1019例患者,均达到了主要终点和关键的次要终点。在PHREEDOM研究中,Xphozah(30mg)组患者的血清磷水平相比安慰剂组平均降低1.37mg/dL;在AMPLIFY研究中,Xphozah(30mg)组患者的血清磷水平平均降低0.84mg/dL,安慰剂组则降低0.19mg/dL。 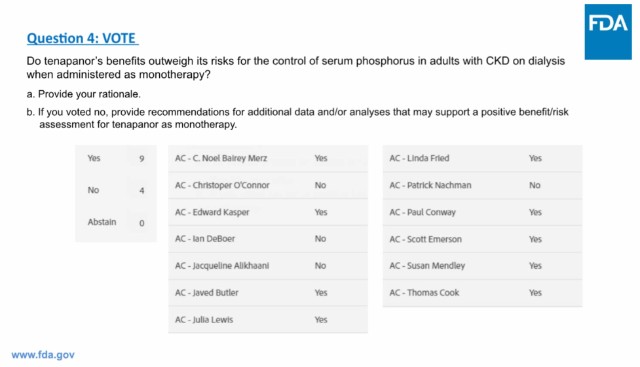
PHREEDOM研究结果(来源:FDA官网)
FDA会议PPT(来源:FDA官网)
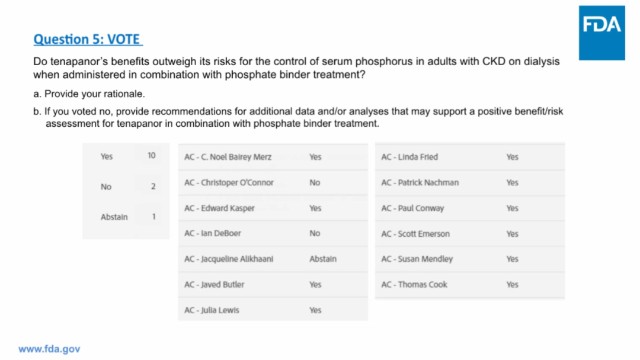
虽然投票结果是好的,但是FDA依然认为Xphozah的疗效较弱,其平均降幅为0.7mg/dL,而已上市药物的降幅为1.5-2.2mg/dL。此外,Xphozah会导致患者长时间严重腹泻(中重度腹泻平均持续43天)。尽管如此,FDA还是在一个月后通过了Ardelyx的上诉。随后,FDA与Ardelyx召开会议讨论了重新提交Xphozah的NDA的途径。至此,Xphozah的上市之旅终于有望迎来一个圆满的结局。
高磷血症(HP)是一种导致血液中血清磷水平异常升高的严重疾病。肾脏是负责调节磷水平的器官,当肾功能明显受损时,磷无法从体内充分排出。因此,接受透析的CKD患者普遍患有高磷血症。全球肾脏病预后组织(KDIGO)指南建议将磷酸盐水平降低至正常范围(2.5-4.5mg/dL)。 Xphozah是Ardelyx开发的一种钠氢交换器3(NHE3)抑制剂,NH3是一种表达于小肠和结肠顶端表面的逆向转运蛋白。Xphozah具有独特的阻断作用机制,通过抑制NHE3收紧细胞之间的连接,从而导致通过细胞旁路(磷酸盐吸收的主要途径)吸收的磷酸盐减少。Xphozah的作用机制(来源:Adelyx官网)
2012年10月,阿斯利康与Ardelyx达成协议,获得该产品的全球权益。但Ardelyx于2015年6月终止了该协议。2017年,协和麒麟和复星医药相继与Ardelyx达成协议,分别获得了该产品的日本权益和中国权益。目前,复星医药已完成了一项Xphozah联合磷结合剂治疗高磷血症的III期研究。 参考资料:1.CRDAC会议视频地址:
https://collaboration.fda.gov/pvp20kxmxixy.
2.CRDAC会议相关文件: https://www.fda.gov/advisory-committees/advisory-committee-
追加内容
本文作者可以追加内容哦 !

