一直以来,PROTAC技术(蛋白降解靶向联合体)由于其靶向不可成药靶点的优势而备受关注,同时,它还能克服耐药性,实现多种给药途径,用量小并且毒性低。
PROTAC的主要原理是利用机体自身的蛋白降解系统泛素-蛋白酶体系统(UPS),2004年,Aaron Ciechanover, Avram Hershko 和 Irwin Rose三位学者因其发现了泛素介导的蛋白质降解而荣获诺贝尔化学奖。
但万物有优势也会有劣势,UPS是胞内蛋白降解的主要途径。也就是说,PROTAC只对胞内蛋白起作用。
2022年,Carolyn R. Bertozzi因为其对点击化学和生物正交化学的贡献成为诺贝尔化学奖得主之一。
2019年,Carolyn创立了一家公司Lycia Therapeutics,开发了新一代靶向蛋白降解技术——LYTAC(溶酶体靶向嵌合体),将靶向范围扩展至胞外和膜相关蛋白。
一代LYTAC
细胞外和膜相关蛋白占据全部编码蛋白的40%,是癌症、老龄化相关疾病和自身免疫性疾病的关键因素。
研究表明,细胞表面溶酶体靶向受体(LTR)家族有助于蛋白质向溶酶体的运输。于是,Carolyn团队提出能结合细胞表面LTR和细胞外蛋白质的嵌合分子可能会诱导靶向蛋白的内化和溶酶体降解
因此,第一代LYTAC应运而生,主要由两部分构成:CI-M6PR的糖聚肽配体(M6Pn)、靶向蛋白的抗体或小分子。两者通过化学链偶联,形成三元复合物,能够介导靶蛋白内吞到胞内,进而被溶酶体降解。
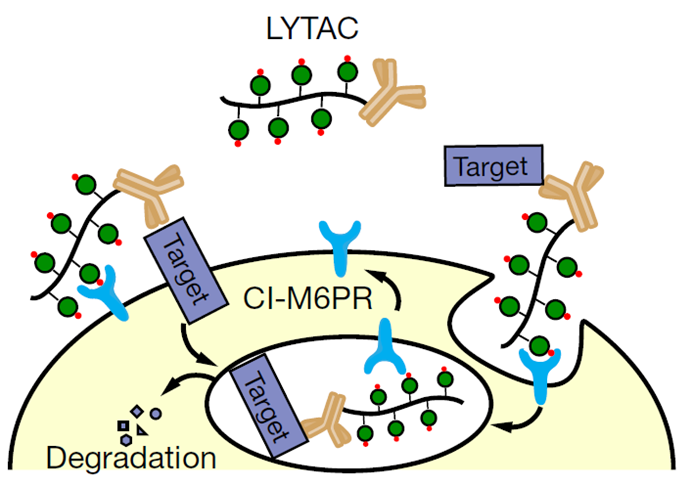
该技术应用范围广泛,可用于自身免疫和炎症性疾病、癌症和神经退行性疾病等。
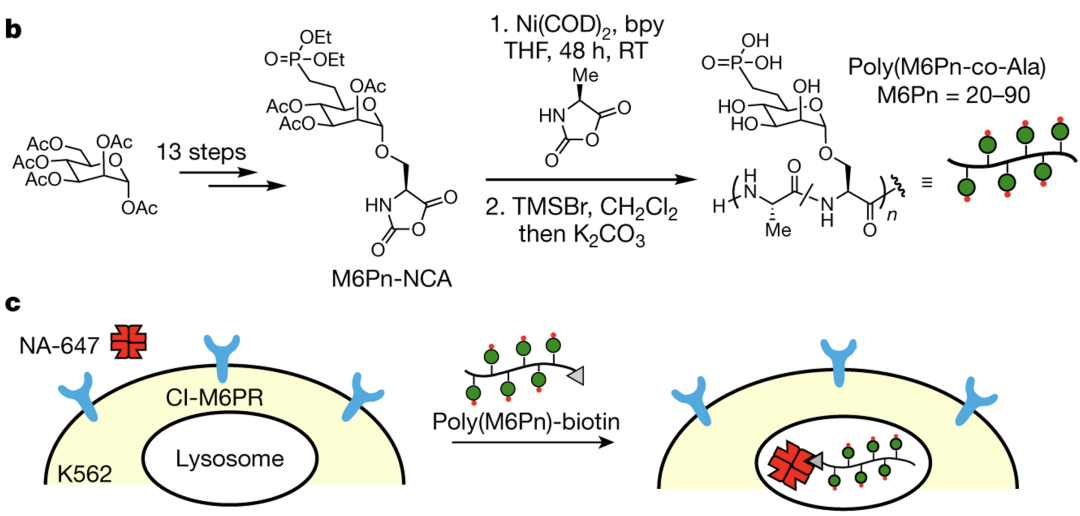
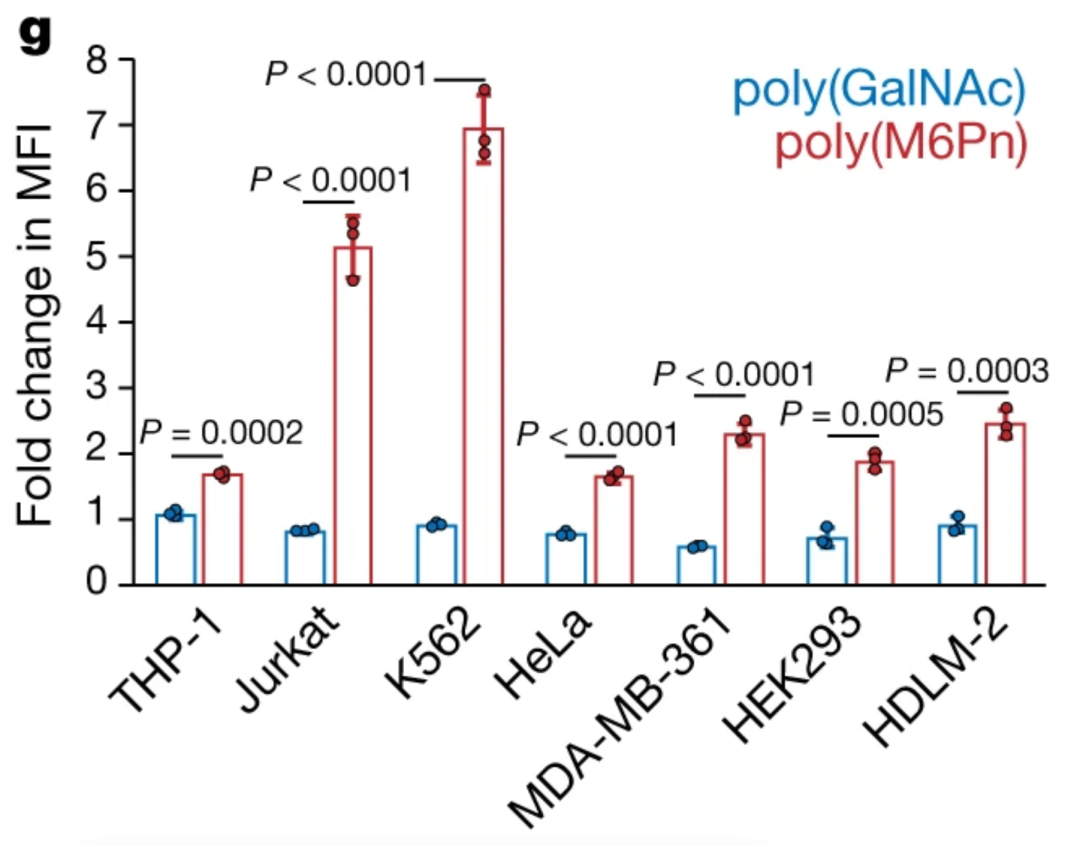
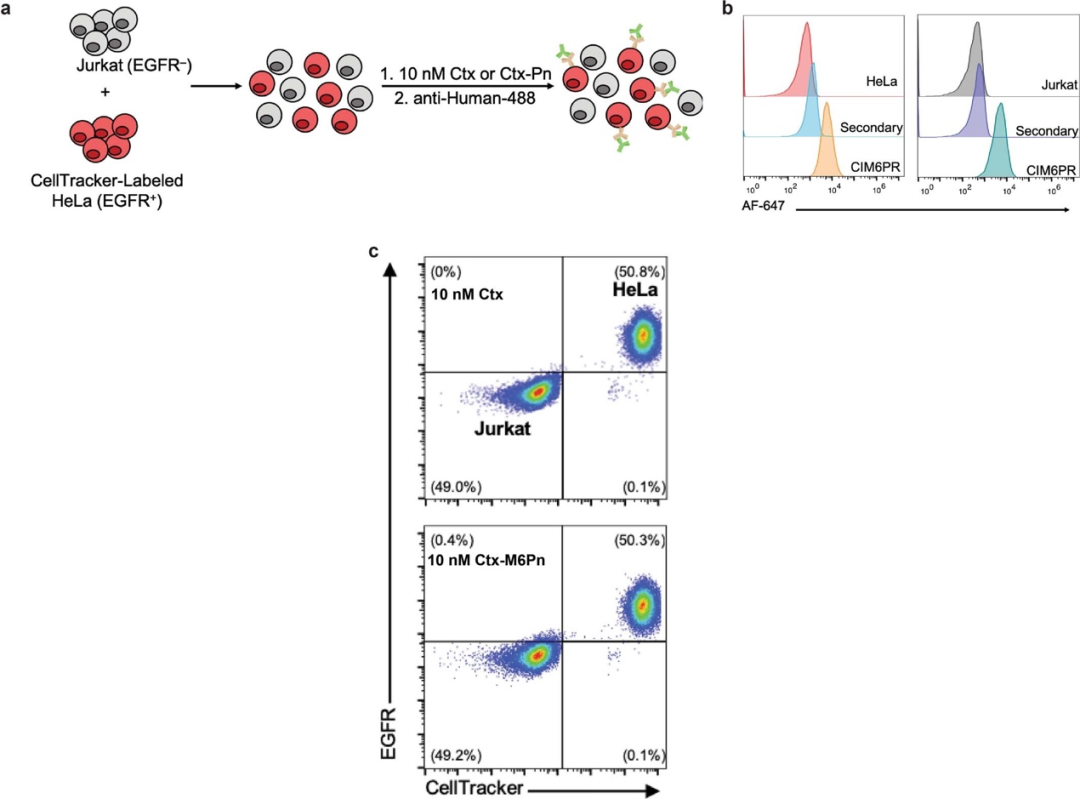
首先,Carolyn团队经体外研究表明,小分子和抗体都可作为靶蛋白结合物。
生物素化的LYTACs在各种细胞系中均有效促进胞外蛋白NA-647的内吞,表明了CI-M6PR靶向的广泛性以及使用小分子作为LYTAC "弹头 "的能力。
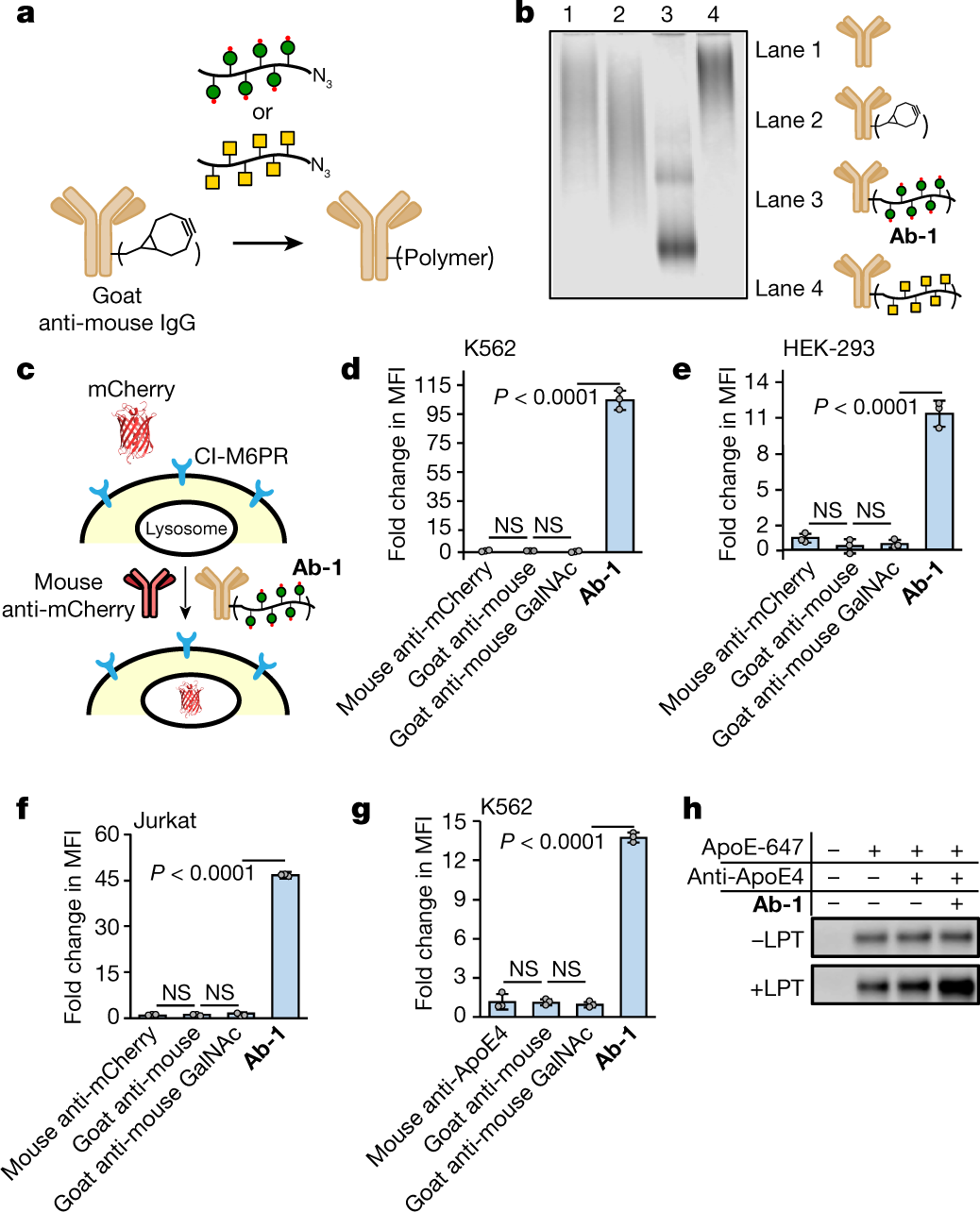
当糖聚肽配体(M6Pn)与抗体偶联时,其偶联物(Ab-1)能够重新编程抗体,使其快速介导靶向蛋白内吞和溶酶体的降解。
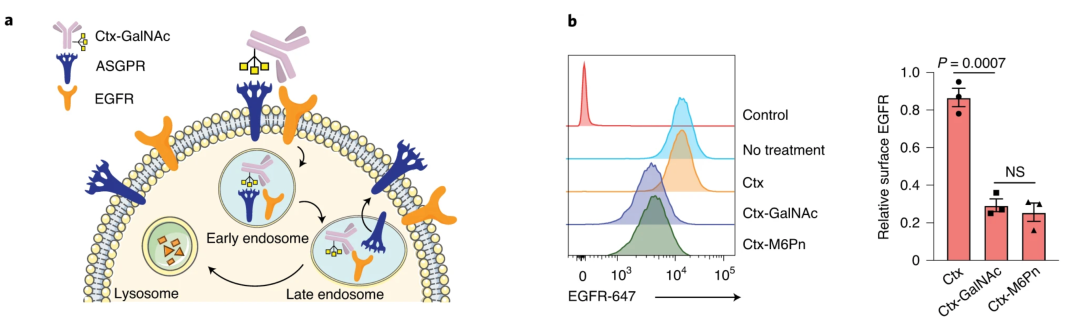
探究了胞外蛋白的降解效果后,研究人员进一步研究了LYTAC对膜蛋白的降解效果,通过EGFR抗体西妥昔单抗(ctx)构建了M6Pn-ctx偶联物,这种偶联物对EGFR和CI-M6PR具有双重亲和力,并具有和ctx相当的靶向特异性,在乳腺癌和肝细胞癌细胞系中能有效降解EGFR。
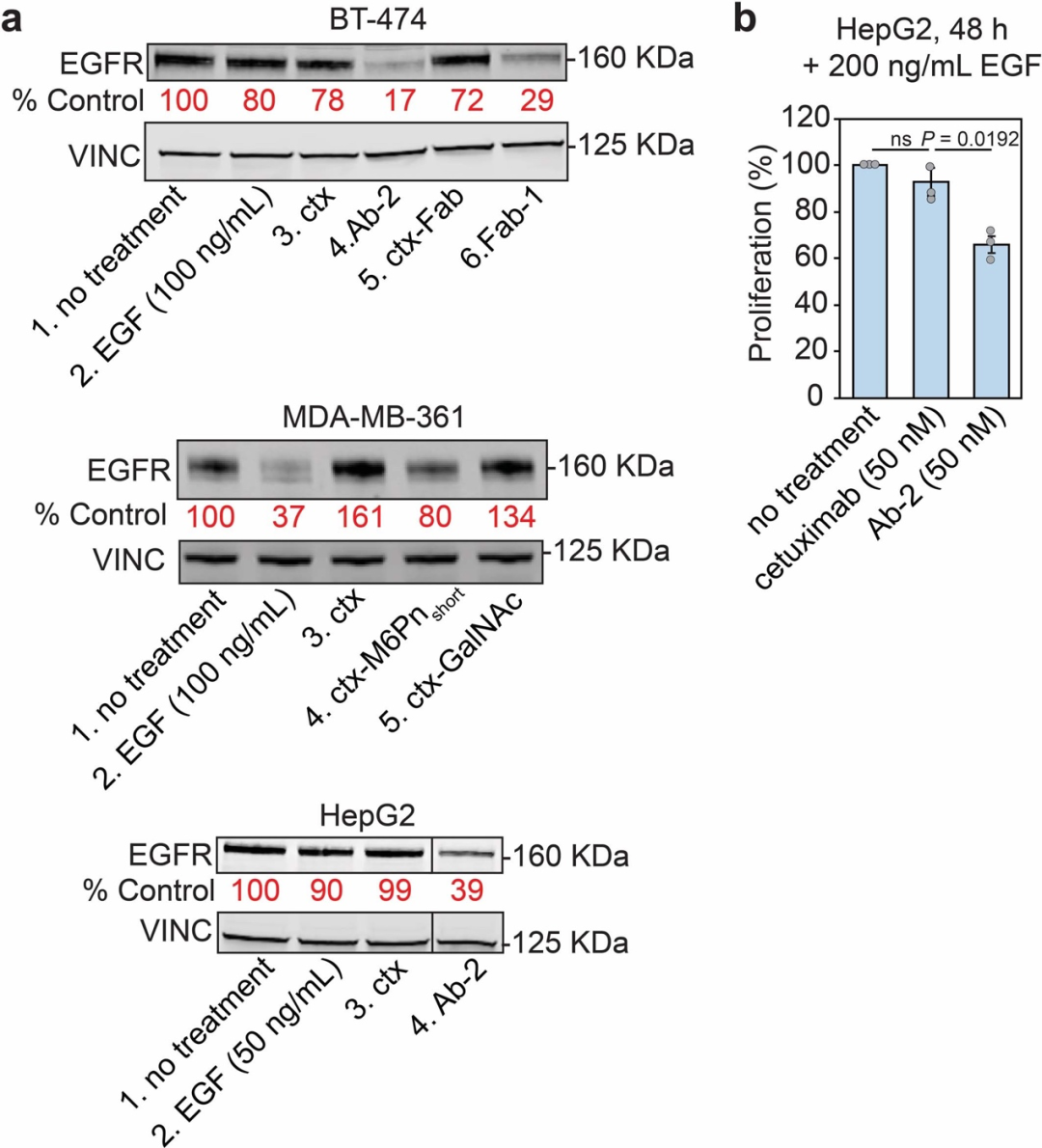
同时,研究还发现LYTAC具有广泛的靶向蛋白应用范围,包括多种癌症及其他疾病治疗靶点如CD71、PD-L1、APOE4和EGFR等。
二代LYTAC
目前LTR主要有两种:CI-M6PR和ASGPR,其对应的配体分别是M6P和GalNAc。
CI-M6PR可在多数组织中广泛表达,而ASGPR在肝脏组织中特异性表达。二代LYTAC便是结合ASGPR,以实现特异性降解胞外蛋白,同时不对溶酶体造成破坏。
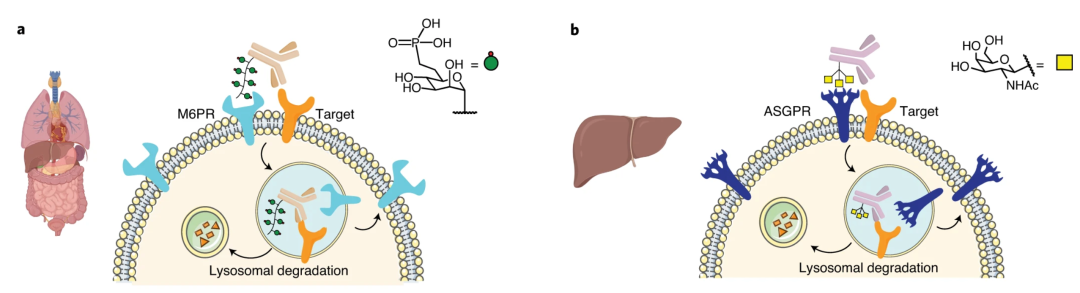
二代LYTAC主要由蛋白结合物和tri-GalNAc偶联而成(GalNAc-LYTAC),使ASGPR参与驱动蛋白下调。与抗体药物相比,GalNAc-LYTAC能降解EGFR并减弱其信号传导。
研究表明,与M6Pn-LYTAC相比,GalNAc-LYTAC的内化效率更高。通过HER2抗体Pertuzumab(Ptz)构建的Ptz-GalNAc和Ptz-M6Pn对比显示,在治疗后2小时,Ptz-GalNAc便表现出HER2的内化,而Ptz-M6Pn并没有。
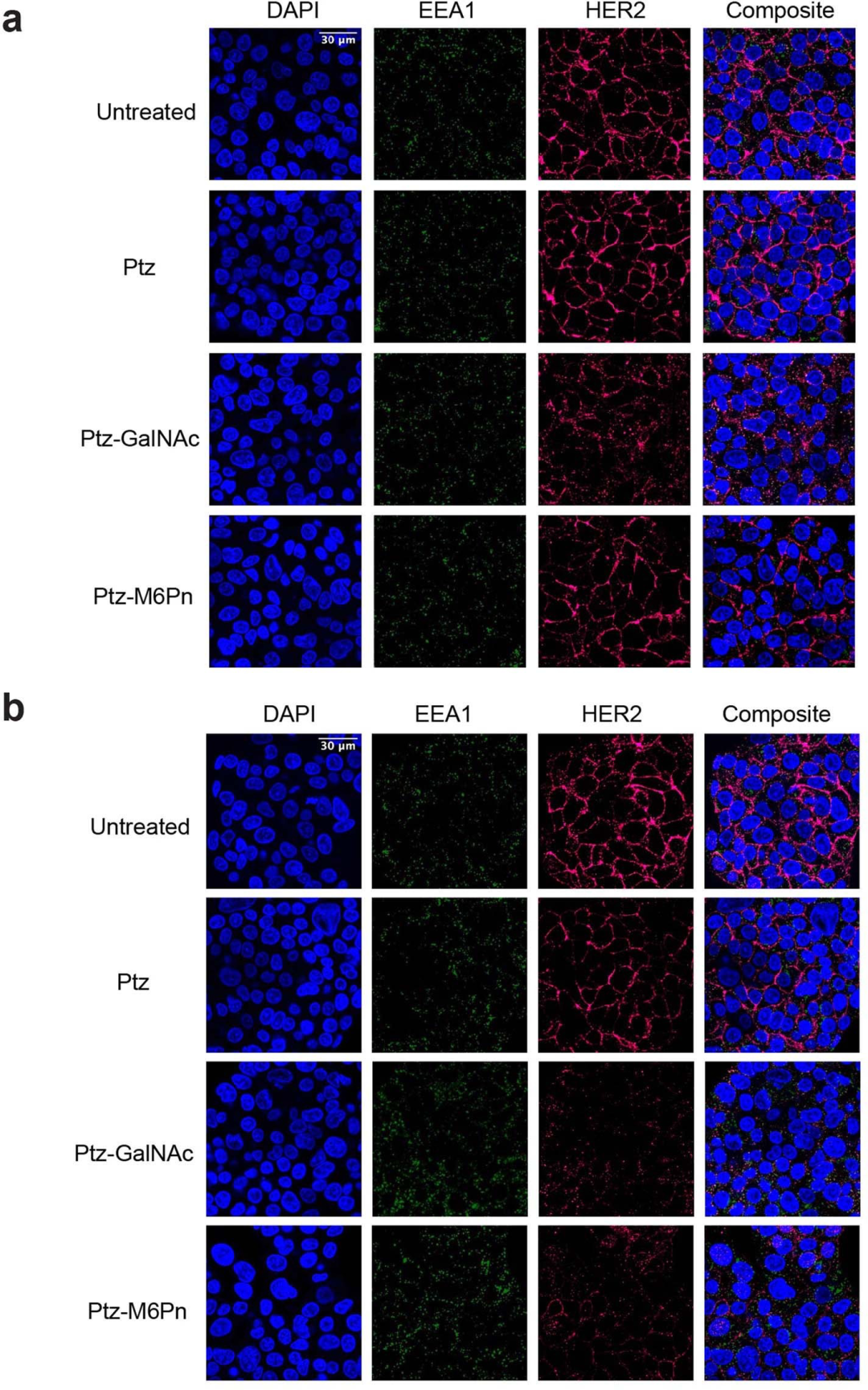
Ctx-GalNAc在HEP3B细胞中的EGFR降解水平与M6Pn-LYTAC相当,能降解>70%的细胞表面EGFR。
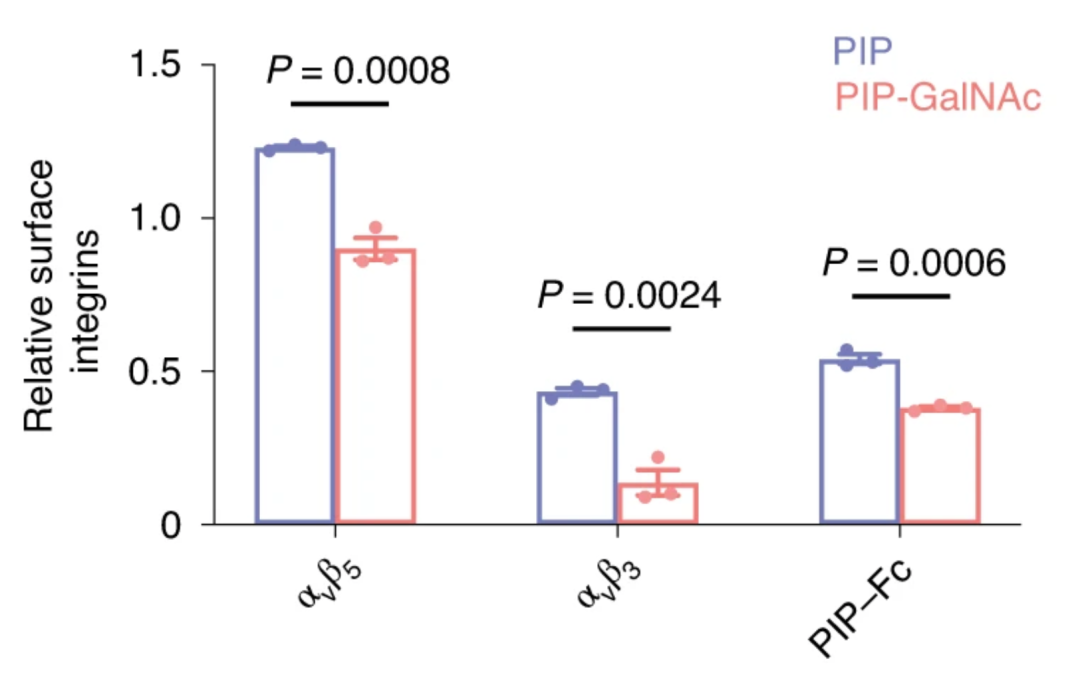
除大分子抗体外,小分子多肽结合也能发挥作用。由3.4kDa的多肽与三聚糖配体相连组成的LYTAC,与单个多肽相比(降解40%),能有效降解癌细胞中过表达的整合蛋白(降解60%),并减少癌细胞增殖。
小结:Lycia Therapeutics公司于2019年成立,目前药物管线具体信息未披露,但其自有的LYTAC平台不光将靶向蛋白降解从胞内扩展到胞外和膜蛋白,还扩大了靶向结合物范围,包括小分子、低分子、单抗和双抗。
目前,Lycia已经在多种模式下生成了数百个LYTACs。成立不到3年已融资超1.4亿,21年8月,Lycia与礼来达成16亿美元合作,通过LYTAC平台合作开发超五种新型靶向药物,期待Lycia药物尽快步入临床。
关注wechat药研网
本文作者可以追加内容哦 !


