FDA拒绝NASH新药奥贝胆酸上市,Intercept终止该适应症开发
炒股第一步,先开个股票账户

6月22日,Intercept Pharmaceuticals宣布已收到美国(FDA)的完整回应函(CRL),以回应该公司奥贝胆酸(Ocaliva,OCA)用于治疗非酒精性脂肪性肝炎(NASH)引起的肝硬化前期伴有肝纤维化患者的新药申请(NDA)。
FDA在CRL中表示,他们已经完成了对NDA的审查,并确定目前的数据不支持奥贝胆酸获得批准。根据CRL的内容,任何重新提交有关奥贝胆酸治疗NASH的NDA,都至少需要成功完成REGENERATE研究的长期结果阶段。基于CRL,Intercept决定停止所有NASH相关投资,重组公司业务以加强对罕见和严重肝脏疾病的关注,并从2024年开始加速实现盈利。 奥贝胆酸是一种法尼酯X受体(FXR)激动剂,FXR通常在肠与肝脏中表达,是胆酸、炎症反应、纤维化与代谢通路的关键调节分子;FXR的活化可以降低肝细胞内的胆酸浓度。2015年1月,奥贝胆酸被FDA授予了治疗伴有肝纤维化NASH患者的突破性疗法资格认定,2016年5月首获FDA批准治疗原发性胆汁性胆管炎。财报显示,该产品2021年销售额为3.64亿美元。
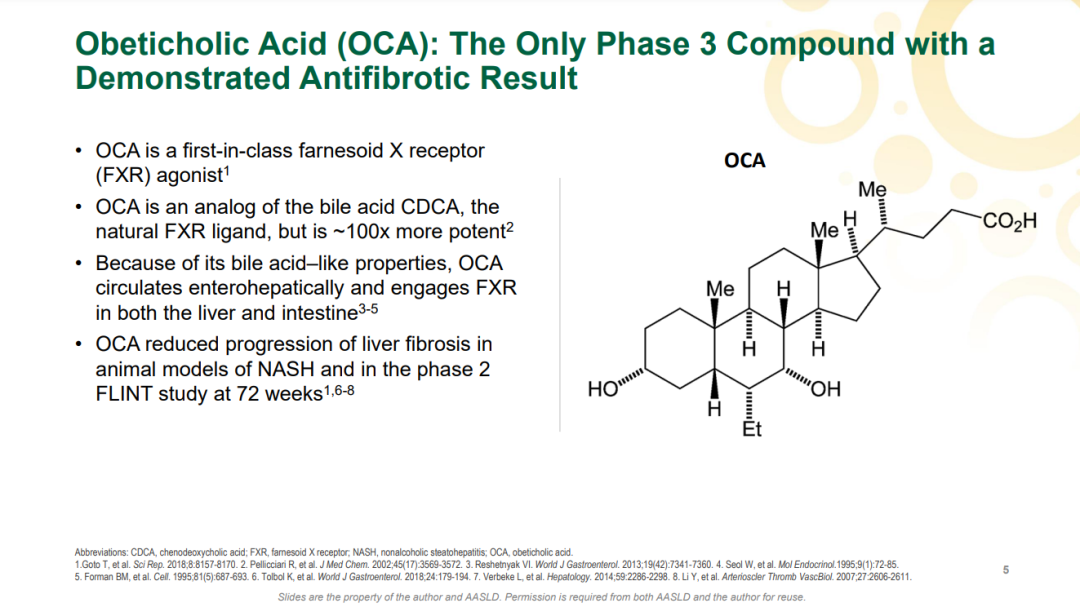
来源:Intercept官网 奥贝胆酸是全球第一个进入III期临床的NASH药物。2019年9月,Intercept曾基于第一次期中分析结果递交上市申请,不过由于组织学终点数据带来的获益仍具有不确定性被FDA拒绝批准治疗NASH肝纤维化。 此次上市申请资料递交主要是基于III期REGENERATE研究的两次期中分析数据。REGENERATE是一项正在进行的多中心、随机、双盲、安慰剂对照的III期研究,共纳入2480例患者,旨在评估奥贝胆酸(10mg和25mg)治疗伴有肝纤维化的非肝硬化NASH患者的安全性和有效性。该研究的主要终点为第18个月时患者的组织学改善效果(达到肝纤维化程度至少改善1级且未出现NASH恶化的患者比例)、7年内的全因死亡率以及肝脏相关临床结果。 2022年7月,Intercept公布了REGENERATE研究中第一个主要终点的第二次期中分析数据。结果显示,接受奥贝胆酸(25mg,每日1次)治疗18个月时有22.4%的患者实现了纤维化程度至少改善1级且未出现NASH恶化,而安慰剂组达到该指标的患者只有9.6%(p<0.0001)。10mg奥贝胆酸组的数据与安慰剂组没有统计学差异。
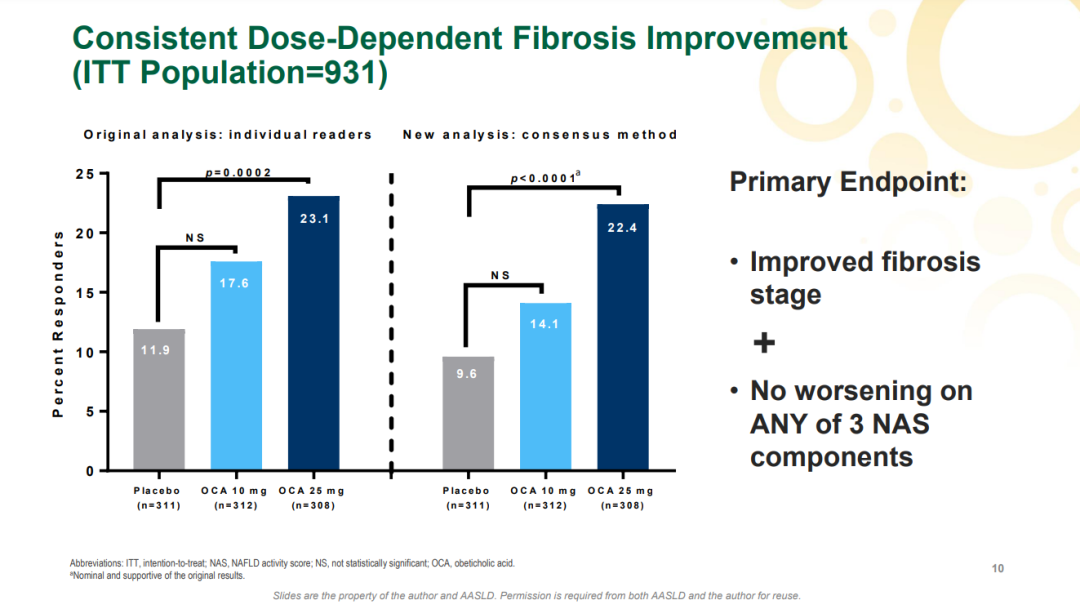
肝脏组织学的改善只是REGENERATE研究2个主要终点之一,这部分数据仅支持奥贝胆酸申请加速批准。此前,该研究还在收集另一个主要终点全因死亡率和肝脏相关临床数据。不过,Intercept已放弃该适应症进一步开发。 2023年5月19日,FDA就奥贝胆酸召开了胃肠药物咨询委员会。投票结果如下:12人反对,2人支持,2人弃权。专家们认为,25mg奥贝胆酸对肝纤维化2~3级NASH患者的风险大于益处。此外,针对是否能以加速批准的审评方式批准其上市时,专家小组以15:1的投票结果表示反对。持反对意见的专家们认为,关于奥贝胆酸的临床试验使用了替代终点,而且奥贝胆酸还有引起药物性肝损伤的风险。 此前也有分析师预测奥贝胆酸不太可能获得批准,主要是因为该药物的安全性存在不确定性。 奥贝胆酸虽未成功获FDA批准,不过,其潜在竞争对手可能会夺得先机。不久前,Madrigal Pharmaceuticals主要候选药物resmetirom治疗NASH的III期研究也达到肝脏组织学主要终点,有望尽快递交上市申请以寻求加速批准。
推荐阅读:
NASH新药曙光已现
Copyright 2023 PHARMCUBE. All Rights Reserved. 欢迎转发分享及合理引用,引用时请在显要位置标明文章来源;如需转载,请给微信公众号后台留言或发送消息,并注明公众号名称及ID。 免责申明:本微信文章中的信息仅供一般参考之用,不可直接作为决策内容,医药魔方不对任何主体因使用本文内容而导致的任何损失承担责任。
恭喜解锁12个月手机L2专属领取资格,立即领取>>
郑重声明:用户在社区发表的所有信息将由本网站记录保存,仅代表作者个人观点,与本网站立场无关,不对您构成任何投资建议,据此操作风险自担。请勿相信代客理财、免费荐股和炒股培训等宣传内容,远离非法证券活动。请勿添加发言用户的手机号码、公众号、微博、微信及QQ等信息,谨防上当受骗!
医药魔方致力于以数据解读行业、以数据助力行业、以数据引领行业,促进医药行业生态更加高效、透明和公平。

郑重声明:东方财富网发布此信息的目的在于传播更多信息,与本站立场无关。东方财富网不保证该信息(包括但不限于文字、视频、音频、数据及图表)全部或者部分内容的准确性、真实性、完整性、有效性、及时性、原创性等。相关信息并未经过本网站证实,不对您构成任何投资建议,据此操作,风险自担。
 6月22日,Intercept Pharmaceuticals宣布已收到美国(FDA)的完整回应函(CRL),以回应该公司奥贝胆酸(Ocaliva,OCA)用于治疗非酒精性脂肪性肝炎(NASH)引起的肝硬化前期伴有肝纤维化患者的新药申请(NDA)。 FDA在CRL中表示,他们已经完成了对NDA的审查,并确定目前的数据不支持奥贝胆酸获得批准。根据CRL的内容,任何重新提交有关奥贝胆酸治疗NASH的NDA,都至少需要成功完成REGENERATE研究的长期结果阶段。基于CRL,Intercept决定停止所有NASH相关投资,重组公司业务以加强对罕见和严重肝脏疾病的关注,并从2024年开始加速实现盈利。 奥贝胆酸是一种法尼酯X受体(FXR)激动剂,FXR通常在肠与肝脏中表达,是胆酸、炎症反应、纤维化与代谢通路的关键调节分子;FXR的活化可以降低肝细胞内的胆酸浓度。2015年1月,奥贝胆酸被FDA授予了治疗伴有肝纤维化NASH患者的突破性疗法资格认定,2016年5月首获FDA批准治疗原发性胆汁性胆管炎。财报显示,该产品2021年销售额为3.64亿美元。
6月22日,Intercept Pharmaceuticals宣布已收到美国(FDA)的完整回应函(CRL),以回应该公司奥贝胆酸(Ocaliva,OCA)用于治疗非酒精性脂肪性肝炎(NASH)引起的肝硬化前期伴有肝纤维化患者的新药申请(NDA)。 FDA在CRL中表示,他们已经完成了对NDA的审查,并确定目前的数据不支持奥贝胆酸获得批准。根据CRL的内容,任何重新提交有关奥贝胆酸治疗NASH的NDA,都至少需要成功完成REGENERATE研究的长期结果阶段。基于CRL,Intercept决定停止所有NASH相关投资,重组公司业务以加强对罕见和严重肝脏疾病的关注,并从2024年开始加速实现盈利。 奥贝胆酸是一种法尼酯X受体(FXR)激动剂,FXR通常在肠与肝脏中表达,是胆酸、炎症反应、纤维化与代谢通路的关键调节分子;FXR的活化可以降低肝细胞内的胆酸浓度。2015年1月,奥贝胆酸被FDA授予了治疗伴有肝纤维化NASH患者的突破性疗法资格认定,2016年5月首获FDA批准治疗原发性胆汁性胆管炎。财报显示,该产品2021年销售额为3.64亿美元。 



