7月24日,CDE官方显示,礼来的Mirikizumab注射液拟纳入突破性治疗品种,拟定适应症是用于治疗中重度活动性克罗恩病(CD)成人患者。
Mirikizumab是一种靶向IL-23 p19亚基的人源化IgG4单克隆抗体。
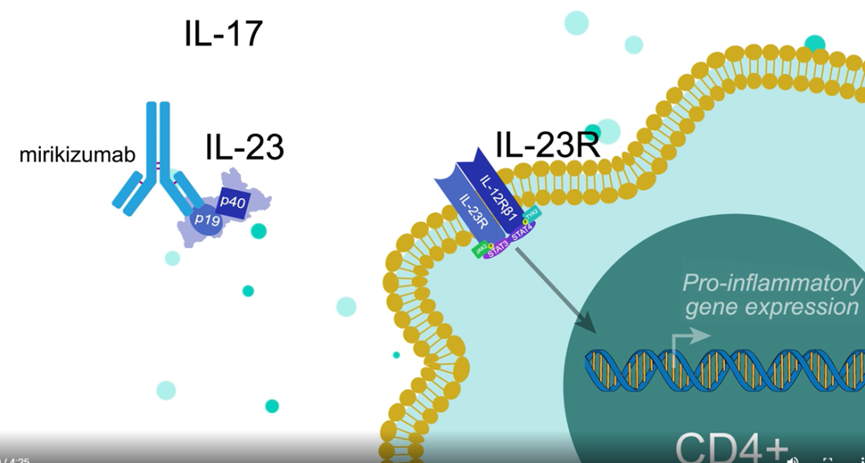
Mirikizumab正在研究用于治疗免疫介导性疾病, 包括溃疡性结肠炎和克罗恩病。
2021年,礼来公布了2期(SERENITY)CD研究数据。
SERENITY是一项多中心、随机、平行、双盲、安慰剂对照的2期临床试验,旨在评估Mirikizumab在中重度活动性克罗恩病患者中的安全性和有效性。
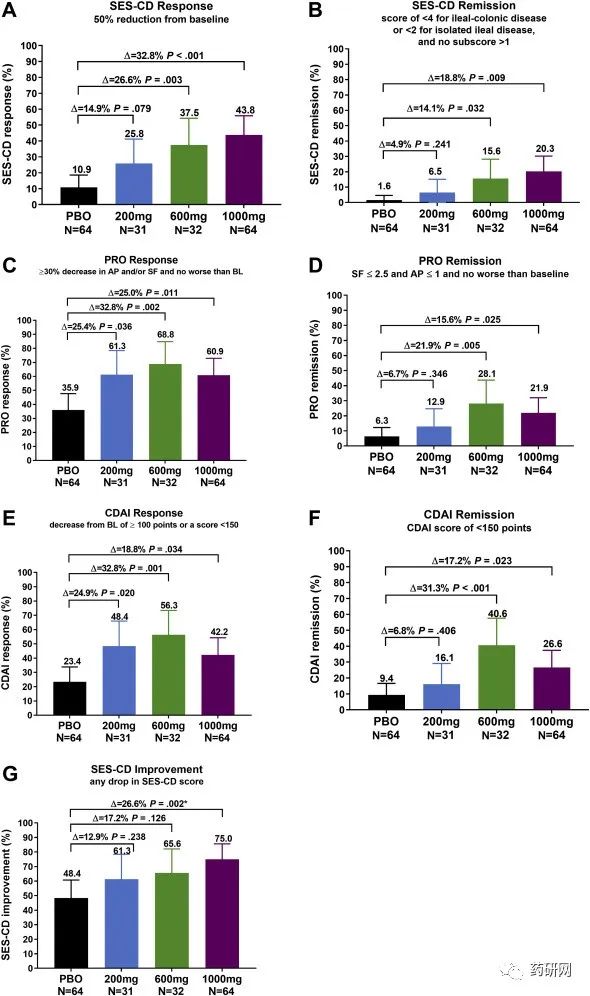
在基线时,参与者按 2:1:1:2 的比例随机分配到四个治疗组(安慰剂、200 mg、 600 mg、1000mg)。主要终点是内镜缓解。
结果显示,第12周的内镜反应达到了主要终点,与PBO相比,3个mirikizumab组的反应均显著较高
mirikizumab 200 mg:8/31, 25.8% [10.4-41.2], P = .079;
mirikizumab 600 mg:12/32, 37.5% [20.7-54.3], P = .003;
mirikizumab 1000 mg: 28/64, 43.8% [31.6-55.9], P < .001;
PBO: 7/64, 10.9% [3.3-18.6])
在12周的诱导期内,与安慰剂相比,Mirikizumab治疗组的患者疲劳显著改善(通过FACIT-疲劳评分相对于基线的平均变化)。不同剂量的Mirikizumab的FACIT-评分至少在9分以上,而安慰剂组不到3分。
继续给药一年后(52周),Mirikizumab治疗组患者的疲劳仍处于持续改善状态,且安全性和耐受性良好。
关注wechat药研网
本文作者可以追加内容哦 !

