挑战阿柏西普!信达生物CR1/VEGFR融合蛋白启动III期研究

7月28日,信达生物在药物临床试验登记与信息公示平台登记了一项III期临床试验,旨在评估IBI302(8mg)对比阿柏西普(2mg)治疗新生血管性年龄相关性黄斑变性(nAMD)的有效性和安全性。
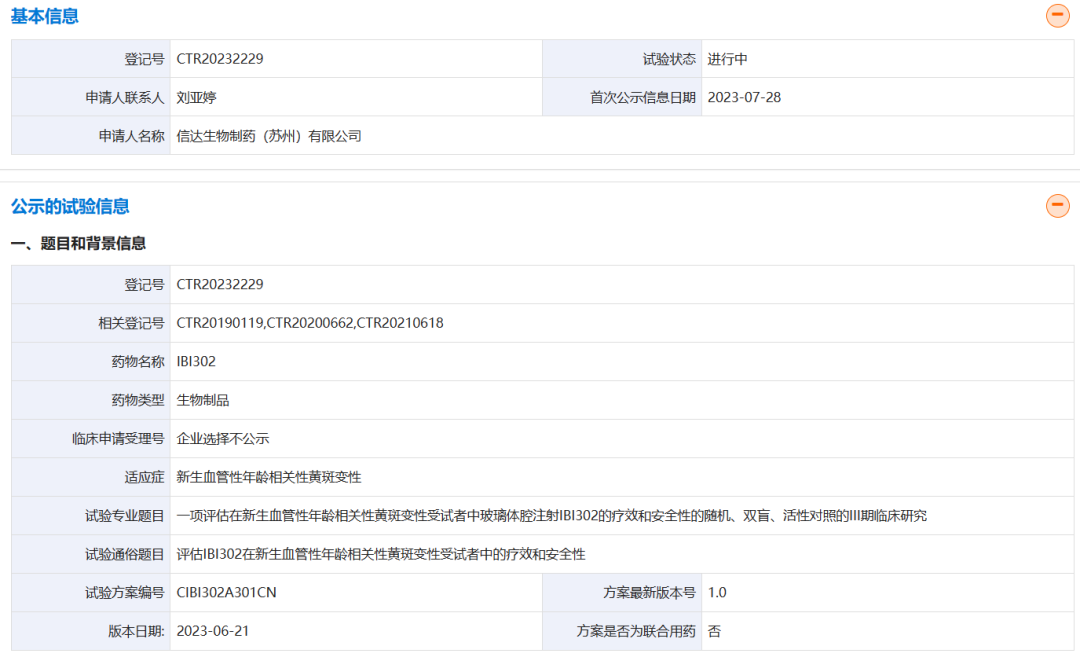
IBI302(efdamrofusp alfa)是信达生物在2012年自圆祥生命科技(前称:ProtevoBio)引进的一款同时靶向补体受体1(CR1)和血管内皮生长因子受体(VEGFR)的双特异性融合蛋白,该笔交易首付款为25万美元,总金额为450万美元。
该产品也是全球首款CR1/VEGFR双特异性融合蛋白。 IBI302的N末端可与VEGF家族结合并阻断其介导的信号通路,从而抑制血管上皮细胞增殖和血管生成,降低血管通透性和减少渗漏;IBI302的C末端可以特异性结合C3b和C4b并抑制二者介导的补体激活经典途径和补体激活替代途径,减少补体介导的炎症反应。通过以上两种机制,IBI302可以实现治疗和控制nAMD的目的。 此前,信达生物已完成两项IBI302治疗nAMD的I期临床研究。结果表明,IBI302具有良好的安全性和耐受性,患者接受治疗后视力明显改善且视网膜水肿也有所减少。
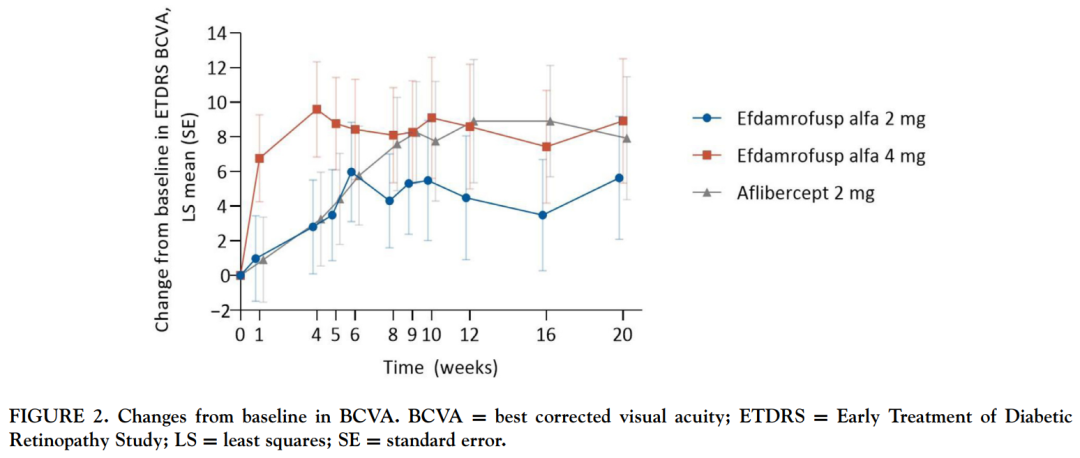
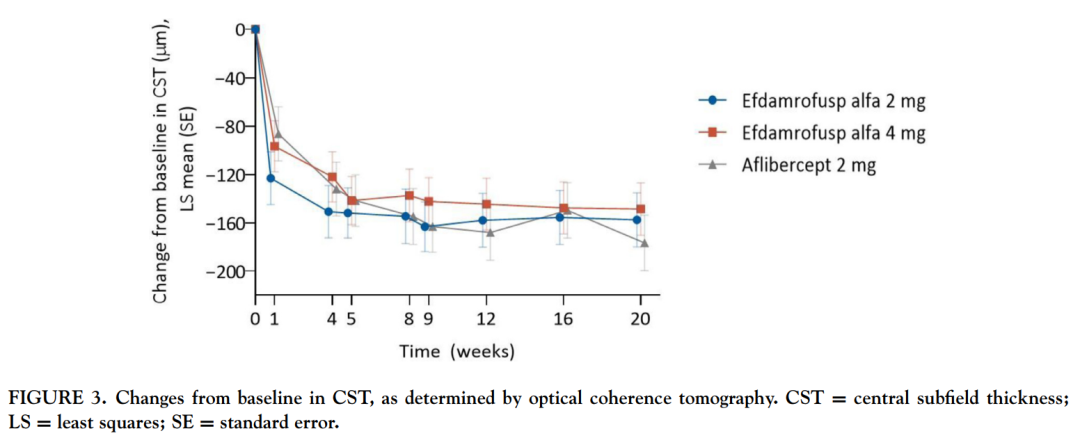
来源:American Journal of Ophthalmology 除了IBI302以外,
荣昌生物的VEGFR/FGFR双抗RC28-E也开展了头对头阿柏西普的III期临床试验(见:
荣昌生物启动RC28-E治疗湿性年龄相关性黄斑变性III期临床试验)。 年龄相关性黄斑变性(AMD)是一种与年龄相关的可导致视力丧失的视网膜疾病,是老年人视力弱和失明的主要原因。按临床表现和病理类型,AMD可分为干性AMD和nAMD,其中前者占80%-90%。在中央视力严重受损的患者中,nAMD约占90%。nAMD的特征是脉络膜新生血管形成(CNV),可导致视网膜渗出、黄斑下出血和视网膜下纤维化瘢痕形成。 据WHO统计,2020年全球AMD患者约1.96亿,2040年,这一数字将达到2.88亿。我国50岁以上和70岁以上人群的AMD患病率分别为10%和20.2%。目前,全球共7款眼部注射制剂获批治疗nAMD,分别为培加他尼、阿柏西普、康柏西普、雷珠单抗、布西珠单抗、Susvimo和法瑞西单抗,均为针对VEGF/VEGFR的疗法。其中,阿柏西普是目前最畅销的一款眼科药物,2022年销售额达62.65亿美元;法瑞西单抗是目前市场增长潜力最大的一款眼科产品,上市第二年即成长为“重磅炸弹”。 不过,VEGF/VEGFR疗法并非完全有效,仍有超过30%患者的病情进展为严重疾病,并且现有疗法对患者视力的增益效果无法长年维持。nAMD患者仍然存在巨大未被满足的临床需求。
推荐阅读
中国创新药需要“头铁”玩家
罗氏2023H1:眼科双抗破10亿美元,中国区收入超30亿美元
Copyright 2023 PHARMCUBE. All Rights Reserved.
欢迎转发分享及合理引用,引用时请在显要位置标明文章来源;如需转载,请给微信公众号后台留言或发送消息,并注明公众号名称及ID。
免责申明:本微信文章中的信息仅供一般参考之用,不可直接作为决策内容,医药魔方不对任何主体因使用本文内容而导致的任何损失承担责任。
郑重声明:用户在社区发表的所有信息将由本网站记录保存,仅代表作者个人观点,与本网站立场无关,不对您构成任何投资建议,据此操作风险自担。请勿相信代客理财、免费荐股和炒股培训等宣传内容,远离非法证券活动。请勿添加发言用户的手机号码、公众号、微博、微信及QQ等信息,谨防上当受骗!

郑重声明:东方财富网发布此信息的目的在于传播更多信息,与本站立场无关。东方财富网不保证该信息(包括但不限于文字、视频、音频、数据及图表)全部或者部分内容的准确性、真实性、完整性、有效性、及时性、原创性等。相关信息并未经过本网站证实,不对您构成任何投资建议,据此操作,风险自担。
 7月28日,信达生物在药物临床试验登记与信息公示平台登记了一项III期临床试验,旨在评估IBI302(8mg)对比阿柏西普(2mg)治疗新生血管性年龄相关性黄斑变性(nAMD)的有效性和安全性。
7月28日,信达生物在药物临床试验登记与信息公示平台登记了一项III期临床试验,旨在评估IBI302(8mg)对比阿柏西普(2mg)治疗新生血管性年龄相关性黄斑变性(nAMD)的有效性和安全性。  IBI302(efdamrofusp alfa)是信达生物在2012年自圆祥生命科技(前称:ProtevoBio)引进的一款同时靶向补体受体1(CR1)和血管内皮生长因子受体(VEGFR)的双特异性融合蛋白,该笔交易首付款为25万美元,总金额为450万美元。该产品也是全球首款CR1/VEGFR双特异性融合蛋白。 IBI302的N末端可与VEGF家族结合并阻断其介导的信号通路,从而抑制血管上皮细胞增殖和血管生成,降低血管通透性和减少渗漏;IBI302的C末端可以特异性结合C3b和C4b并抑制二者介导的补体激活经典途径和补体激活替代途径,减少补体介导的炎症反应。通过以上两种机制,IBI302可以实现治疗和控制nAMD的目的。 此前,信达生物已完成两项IBI302治疗nAMD的I期临床研究。结果表明,IBI302具有良好的安全性和耐受性,患者接受治疗后视力明显改善且视网膜水肿也有所减少。
IBI302(efdamrofusp alfa)是信达生物在2012年自圆祥生命科技(前称:ProtevoBio)引进的一款同时靶向补体受体1(CR1)和血管内皮生长因子受体(VEGFR)的双特异性融合蛋白,该笔交易首付款为25万美元,总金额为450万美元。该产品也是全球首款CR1/VEGFR双特异性融合蛋白。 IBI302的N末端可与VEGF家族结合并阻断其介导的信号通路,从而抑制血管上皮细胞增殖和血管生成,降低血管通透性和减少渗漏;IBI302的C末端可以特异性结合C3b和C4b并抑制二者介导的补体激活经典途径和补体激活替代途径,减少补体介导的炎症反应。通过以上两种机制,IBI302可以实现治疗和控制nAMD的目的。 此前,信达生物已完成两项IBI302治疗nAMD的I期临床研究。结果表明,IBI302具有良好的安全性和耐受性,患者接受治疗后视力明显改善且视网膜水肿也有所减少。


